题目内容
14.下表是周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物碱性最强的物质的电子式是
 ,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;
,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是HF;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式NaH+H2O=NaOH+H2↑.
分析 由元素在周期表中的位置可知,A为H、B为Na、C为Al、D为C、E为N、F为P、G为F、H为Cl、I为Ar、J为Si元素,
(1)这些元素中,稀有气体化学性质最不活泼;只有负化合价没有正化合价的元素是F元素;Si是重要的半导体材料;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;呈两性的物质是氢氧化铝;
(3)元素的非金属性越强,其氢化物的稳定性越强;
(4)A、B元素形成的化合物是NaH,NaH和水反应后溶液呈碱性,说明有NaOH生成,同时生成一种可溶性气体,根据元素守恒知生成气体是氢气.
解答 解:由元素在周期表中的位置可知,A为H、B为Na、C为Al、D为C、E为N、F为P、G为F、H为Cl、I为Ar、J为Si元素,
(1)稀有气体性质最不活泼,位于金属和非金属分界线附近的元素能用于作半导体材料,所以化学性质最不活泼的是Ar,可用于制半导体材料的元素是Si,F元素只有负价而无正价;
故答案为:Ar;F;Si
(2)上述元素中,Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,其电子式为 ,元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据元素周期律知,非金属性最强的元素是F,但F元素没有含氧酸,非金属性次之的是Cl元素,其最高价含氧酸是HClO4,所以酸性最强的酸是HClO4,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
,元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据元素周期律知,非金属性最强的元素是F,但F元素没有含氧酸,非金属性次之的是Cl元素,其最高价含氧酸是HClO4,所以酸性最强的酸是HClO4,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
故答案为: ;HClO4;Al(OH)3;
;HClO4;Al(OH)3;
(3)非金属的非金属性越强,其氢化物越稳定,根据元素周期律知,C、N、P、F、Cl 的非金属性最强的是F元素,所以最稳定的氢化物是HF,
故答案为:HF;
(4)Na与H元素反应生成NaH,NaH与水反应生成氢氧化钠与氢气,反应方程式为:NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑.
点评 本题考查元素周期表和元素周期律,明确元素在周期表中的位置是解答本题的关键,然后利用单质、化合物的性质来解答即可,注意规律中的特殊现象.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
| A. | 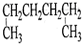 1,4-二甲基丁烷 | B. | 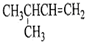 3-甲基丁烯 | C. | 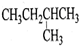 2-甲基丁烷 | D. | 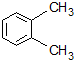 邻二甲苯 |
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
| A. | 一氯甲烷和2-氯丙烷:正丁烷 | |
| B. | 2,2-二甲基-1-氯丙烷与一氯甲烷:2,2-二甲基丁烷 | |
| C. | 1,5-二氯戊烷:环戊烷 | |
| D. | 一氯甲烷和四氯化碳:2,2-二甲基丙烷 |
| A. | 硝酸可以和大理石反应 | |
| B. | 氢氧化铁沉淀可溶于硝酸 | |
| C. | 分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟 | |
| D. | 铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体 |
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |