题目内容
2.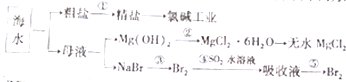 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
分析 A.赤潮是水体富营养化的结果;
B.利用溴单质易挥发分析;
C.在氧化还原反应中,失电子化合价升高的元素被氧化,得到电子元素化合价降低被还原;
D.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求.
解答 解:A.氮和磷大量排入水域后会导致水体富营养化污染,形成赤潮,故A正确;
B.被氧化生成的溴单质易挥发,工业上利用空气吹出法是用于工业规模海水提溴的常用方法,故B正确;
C.在过程③中溴元素化合价-1价变化为0价被氧化,④中溴得电子化合价降低,所以溴元素被还原,故C正确;
D.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,故D错误;
故选D.
点评 本题考查了海水资源及其综合利用,难点是除杂过程中加入药品的先后顺序,要根据物质的特点来分析解答,难度中等.

练习册系列答案
相关题目
12.2009年12月哥本哈根气候变化会议的重要议题是减缓温室气体排除,“节能减排”是达到该目标的必经之路.下列措施无助于节能减排的是( )
| A. | 将白炽灯换成节能灯 | B. | 少开汽车,多骑自行车或坐公交车 | ||
| C. | 用风力发电代替火力发电 | D. | 把高耗能产业转移到欠发达地区 |
13.下列说法不正确的是( )
| A. | 乙醇和乙酸均可与钠反应放出氢气 | |
| B. | 乙烯和苯均能使溴水褪色,且原理相同 | |
| C. | 等物质的量的正丁烷和异丁烷,含有非极性键的数目相同 | |
| D. | 甲烷在光照条件下与Cl2发生取代反应,共得到5种产物 |
10.下列冶炼金属的原理及方程式不正确的是( )
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
17.2015年6月5日世界环境日中国的主题定为“践行绿色生活”,旨在增强全民节约环保的意识,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②实施清洁生产;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料.( )
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
7.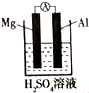 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
请你帮助该同学整理并完成实验报告:
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
(3)此实验的结论:钠、镁、铝的金属性强弱顺序为Na>Mg>Al.
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
14.化学在生产和生活中有着重要的应用.下列说法正确的是( )
| A. | 漂白粉和明矾常用于水处理,这两者净水原理相同 | |
| B. | “地沟油”经过加工处理可用来制肥皂,可实现厨余废物合理利用 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 高炉炼铁的常用FeS2作为炼铁的原料 |
11.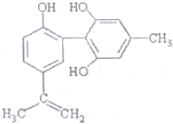 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO,溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质的分子式为C14H28O3 | |
| D. | lmol该物质分别与浓溴水和H2反应时,最多消耗Br3和H2分别为4mol和7mol |
2.下列反应的离子方程式正确的是( )
| A. | 氧化铝和氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| B. | 硫酸溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氯化铝中加入过量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |