题目内容
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
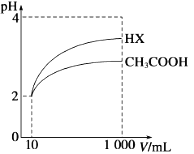
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。
(5)向 0.l molL-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。
【答案】CO32- b H2S+CO32- =HCO3-+HS- 大于 测定0.1mol/L的CH3COONa溶液的pH,若pH>7,说明醋酸是弱酸,即醋酸是弱电解质或测定0.1mol/L的CH3COOH溶液的pH,若pH>1,说明醋酸是弱酸,即醋酸是弱电解质。(其它合理的方法均可) 4
【解析】
(1)电离平衡常数越小表明酸越弱,该酸越难电离出H+,逆向思考得知:电离常数越小,其酸根结合H+能力越强,据此分析。
(2)只有不发生任何反应的离子之间才能大量共存,结合强酸制弱酸原理分析。
(3)根据电离常数可知酸性强弱关系H2CO3>H2S>HCO3->HS-,根据“弱酸能制更弱酸”写出反应的离子方程式。
(4)弱酸溶液中存在电离平衡,稀释使电离平衡向电离方向移动,当pH相同且稀释相同倍数时,酸越弱pH变化程度越小。根据醋酸在水溶液中存在电离平衡CH3COOH![]() CH3COO-+H+选择合适的方法证明醋酸是弱电解质。由此解答。
CH3COO-+H+选择合适的方法证明醋酸是弱电解质。由此解答。
(5)根据电离平衡常数计算出溶液中H+浓度,再根据pH=-lgc(H+)计算溶液的pH。
(1)电离平衡常数越小表明酸越弱,该酸越难电离出H+,逆向思考得知,电离常数越小,其酸根结合H+能力越强。由表格数据知,相关酸的电离常数大小关系为:HF>CH3COOH>H2S>HCO3-,所以结合H+的能力最强的为CO32-。
(2)因电离常数相对大小HS-<HSO3-,且弱酸不能制取较强酸,HS-与SO32-不发生反应,故在溶液中HS-和SO32-可大量共存,a项错误;b.根据电离常数大小HF>CH3COOH,且强酸能制取弱酸,可推知反应HF+CH3COO-=CH3COOH+F-可发生,所以在溶液中HF和CH3COO-不能大量共存,b项正确;c. 因电离常数大小关系H2S>HCO3->HS-,且弱酸不能制取较强酸,它们之间不发生反应,所以在溶液HS-和HCO3-可以大量共存,c项错误;d.根据电离常数大小关系H2SO3>H2CO3>HSO3-,HSO3-和HCO3-之间不发生反应,所以在溶液HSO3-和HCO3-可以大量共存,d项错误;答案选b。
(3)根据电离常数大小关系H2CO3>H2S>HCO3->HS-,可知酸性强弱H2CO3>H2S>HCO3->HS-,根据较强酸制较弱酸原理得离子方程式为H2S+CO32-=HCO3-+HS-。
(4)弱酸溶液中存在电离平衡,加水稀释使电离平衡向电离方向移动,因此,当pH相同且稀释相同倍数时酸越弱,pH变化程度越小。由图像可知,pH均为2的CH3COOH和HX,均稀释100倍后,CH3COOH的pH变化小于HX,表明HX的酸性比醋酸强,所以HX的电离平衡常数大于醋酸的电离平衡常数。测定0.1mol/L的CH3COONa溶液的pH,若pH>7,说明醋酸是弱酸,即醋酸是弱电解质。
(5) HF![]() H++F-,Ka(HF)=
H++F-,Ka(HF)=![]() =7.2×10-4,则c(H+)=
=7.2×10-4,则c(H+)=![]() =
=![]() =10-4mol/L,此时溶液的pH=-lgc(H+)=-lg10-4=4。
=10-4mol/L,此时溶液的pH=-lgc(H+)=-lg10-4=4。

 口算题天天练系列答案
口算题天天练系列答案