题目内容
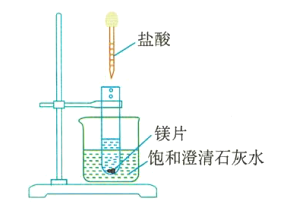
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。

(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
【答案】关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好 短 分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短 多孔塑料袋浸入稀硫酸 反应放热,温度升高反应速率加快 酸中氢离子浓度减小 气体遇冷压缩 v(H+)=0.00125mol/(Ls)
【解析】
(1)检查图1装置气密性,可设法让装置内压强与外界压强不同,根据现象确定气密性情况。
(2)锌粒质量、表面积相同,但两份硫酸溶液中c(H+)不同,后者反应速率快,由此可确定收集25mLH2时所需时间的关系。
(3)同学们在实验操作中发现本实验设计存在明显不足,可从气体体积误差、产生H2时间间隔等分析。
(4)c.塞好橡胶塞,反应刚开始时立即用秒表计时;
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,从影响速率的外界因素寻找原因,反应进行一定时间后速率逐渐减慢,仍从影响速率的因素找原因。
(6) t1~t2时间段,反应已经结束,氢气体积略有减小,则与反应无关,只能从与反应无关的因素中寻找原因;在64s内用H+浓度表示的平均反应速率时,由H2的体积求其物质的量,然后再求出n(H+),最后求出v(H+)。
(1)检查图1装置气密性,可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好。答案为:关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)锌粒质量、表面积相同,但两份硫酸溶液中c(H+)不同,后者反应速率快,由此可确定收集25mLH2时所需时间后者比前者短。答案为:短;
(3)同学们在实验操作中发现本实验设计存在明显不足,可从气体体积误差、产生H2时间间隔等分析,例如分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短。答案为:分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短;
(4)c.塞好橡胶塞,反应刚开始时,即多孔塑料袋浸入稀硫酸时,立即用秒表计时。答案为:多孔塑料袋浸入稀硫酸;
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,因为c(H+)不断减小,所以只能是反应放热,温度升高反应速率加快;反应进行一定时间后速率逐渐减慢,则应为酸中氢离子浓度减小。答案为:反应放热,温度升高反应速率加快;酸中氢离子浓度减小;
(6) t1~t2时间段,反应已经结束,氢气体积略有减小,则应为气体遇冷压缩;H2的物质的量n(H2)=![]() =0.0016mol,n(H+)=2n(H2)=0.0032mol,v(H+)=
=0.0016mol,n(H+)=2n(H2)=0.0032mol,v(H+)=![]() =0.00125mol/(Ls)。答案为:气体遇冷压缩;0.00125mol/(Ls)。
=0.00125mol/(Ls)。答案为:气体遇冷压缩;0.00125mol/(Ls)。

【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。

(5)向 0.l molL-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。