题目内容
13.实验室做乙醛和银氨溶液发生银镜反应的实验时:①为产生光亮的银镜,试管用蒸馏水洗涤后再用NaOH溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净.
②配制银氨溶液时向盛有AgNO3溶液的试管中逐滴滴加氨水溶液边滴边振荡直到先生成的沉淀恰好溶解为止.有关反应的化学方程式:AgNO3+NH3•H2O═AgOH↓+NH4NO3、AgOH+2NH3•H2O═Ag(NH3)2OH+2H2O.
③加热时应用水浴加热,产生银镜的化学方程式为CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O.
分析 ①欲使银镜反应实验成功必须用NaOH溶液煮沸试管以除去油污,以免析出的银难以附着在试管上;
②银氨溶液的配制:取1mL 2%的AgNO3溶液于洁净的试管中,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液;
③为了受热均匀,采用水浴加热,银镜反应的方程式书写,只是官能团-CHO和Ag(NH3)2OH反应,配平方法:1mol-CHO和2molAg(NH3)2OH反应.
解答 解:①欲使银镜反应实验成功必须用NaOH溶液煮沸试管以除去油污,以免析出的银难以附着在试管上,故答案为:NaOH;
②银氨溶液的配制:取1mL 2%的AgNO3溶液于洁净的试管中,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液,化学反应方程式为:AgNO3+NH3•H2O=AgOH↓+NH4NO3,AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O,配制银氨溶液时,一定注意不要溶液滴加到氨水中,应把氨水滴加到AgNO3溶液中,且氨水不要过量,
故答案为:AgNO3;氨水;先生成的沉淀恰好溶解;AgNO3+NH3•H2O=AgOH↓+NH4NO3;AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O;
③为了受热均匀,采用水浴加热,银镜反应的方程式书写,只是官能团-CHO和Ag(NH3)2OH反应,离子反应方程式为:CH3CHO+2[Ag(NH3)2]OH$\stackrel{水浴}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,故答案为:水浴;CH3CHO+2[Ag(NH3)2]OH$\stackrel{水浴}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O.
点评 本题考查乙醛的银镜反应,侧重于除油污、银氨溶液的配制以保证银镜的生成、化学方程式的书写,难度一般,注意配制银氨溶液时,一定注意不要溶液滴加到氨水中,应把氨水滴加到AgNO3溶液中,且氨水不要过量.

| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g)+Cl2 (g)═2HCl(g) | |
| B. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═+183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 |
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
| A. | 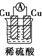 | B. |  | C. | 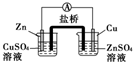 | D. | 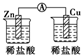 | ||||
| E. | 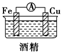 | F. |  |

| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |