题目内容
14.下列有关卤族元素的叙述不正确的是( )| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
分析 A.元素的非金属性越强,其单质的氧化性越强,氟气和水发生剧烈反应生成HF和氧气;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其吸引电子能力越强,其氢化物在水溶液中电离出氢离子能力越弱;
D.卤素单质随着原子序数增大其颜色加深、熔沸点升高.
解答 解:A.元素的非金属性越强,其单质的氧化性越强,氟气和水发生剧烈反应生成HF和氧气,卤素单质中除了氟气外,排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,从氟到碘其非金属性逐渐减弱,则其最高价氧化物的水化物酸性依次减弱,故B正确;
C.元素的非金属性越强,其吸引电子能力越强,其氢化物在水溶液中电离出氢离子能力越弱,从氟到碘其非金属性依次减弱,其氢化物的水溶液酸性依次增强,故C正确;
D.卤素单质从氟气到碘,其单质颜色依次为浅黄绿色、黄绿色、深红棕色、紫黑色,这几种物质的单质都是分子晶体,其单质的熔沸点随着原子序数增大而增大,所以从氟到碘其熔沸点依次升高,故D正确.
故选A.
点评 本题考查卤族元素性质递变规律,注意A中氟气能置换出水中的氧气、C中非金属性与其氢化物溶液酸性强弱关系,AC为易错点.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
2.浓硫酸是一种重要的化工产品.某化学兴趣小组拟探究Cu与浓H2SO4的反应.
Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
Ⅱ.[探究过程]

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
9.下列变化中,属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 铝热反应 |
19.磷酸铁锂电池结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质.在充电过程中,LiFePO4中的锂离子脱出并伴随着铁元素的氧化,下列说法不正确的是( )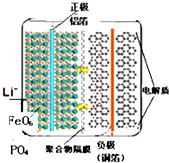

| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
6. 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为3.2g (忽略溶液体积的变化及电极产物可能存在的溶解现象).
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
3.已知:①1mol H2 分子中化学键断裂时需要吸收 436kJ 的能量 ②1mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量 ③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量,则下列叙述正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g)+Cl2 (g)═2HCl(g) | |
| B. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═+183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 |
4.常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液.下列有关判断不正确的是( )
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
