题目内容
16.请写出五种化学性质不同的物质的化学式,这些物质的原子核外都具有10个电子,它们的化学式分别为Ne、HF、H2O、CH4.分析 根据原子的质子数及具有10个电子的分子来书写分子的化学式.
解答 解:因碳的质子数为6,氮的质子数为7,氧的质子数为8,氟的质子数为9,氖的质子数为10,
由原子中的质子数等于电子数,
分子的质子数等于原子的质子数之和,
则具有10个电子的分子的化学式为Ne、HF、H2O、NH3、CH4.
故答案为:Ne;HF;H2O;NH3;CH4.
点评 本题较简单,考查10电子的微粒,明确常见原子的质子数及质子数与电子数的关系即可解答.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
6.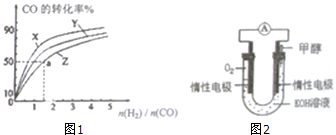 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为3.2g (忽略溶液体积的变化及电极产物可能存在的溶解现象).
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
4.常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液.下列有关判断不正确的是( )
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
11.直接由原子构成的一组物质是( )
| A. | 干冰、二氧化硅、金刚石 | B. | 氧化钠、金刚石、氯化氢 | ||
| C. | 碘、石墨、氯化钠 | D. | 二氧化硅、金刚石、晶体硼 |
1.如图所示的装置能够组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  | ||||
| E. |  | F. | 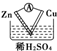 |
5.氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是( )
| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |
6.下列有机物命名正确的是( )
| A. | 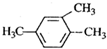 1,3,4-三甲基苯 1,3,4-三甲基苯 | B. | 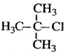 2-甲基-1-氯丙烷 2-甲基-1-氯丙烷 | ||
| C. | 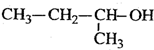 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 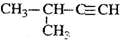 2-甲基-3-丁炔 2-甲基-3-丁炔 |
 ,属于取代反应.
,属于取代反应.