题目内容
10.某学生为了完成一个家庭小实验,自制烷烃的分子模型,对于CnH2n+2的烷烃,做球棍模型时,除需做3n+2个球外还需要的棍(共价键)数为( )| A. | 3n+2 | B. | 3n+1 | C. | 3n | D. | 3n-1 |
分析 烷烃是饱和链烃,烷烃的通式为CnH2n+2,碳原子间以单键连接,碳原子形成四个化学键,除需做3n+2个球外还需要的棍为共价键的数目,即碳氢单键、碳碳单键的数目和.
解答 解:依据烷烃是饱和链烃,碳原子间以单键连接,碳原子形成四个化学键分析判断,烷烃的通式是:CnH2n+2,含有碳碳单键数为n-1,含有碳氢单键数为2n+2,所以做球棍模型时,除需做3n+2个球外还需要n-1+2n+2=3n+1棍,
故选B.
点评 本题考查烷烃中C原子与H原子之间的数量关系,灵活应用有机化合物中碳原子的结构,形成化学键的特征是解答的关键,题目难度不大.

练习册系列答案
相关题目
1.短周期主族元素X、Y、Z、W原子序数依次增大.已知:X、Z同主族,X、Y、Z三种元素原子的最外层电子数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:X<W<Y<Z | |
| B. | X的氢化物稳定性大于Z的氢化物稳定性 | |
| C. | X在自然界中只能以化合态形式存在 | |
| D. | W的单质可使干燥的红色布条褪色 |
18.下列元素所在的周期数与族序数相等的是( )
| A. | 氧 | B. | 氯 | C. | 钠 | D. | 氢 |
5.实验中需用2.0mol/L的Na2CO3溶液950mL,配制时应称取Na2CO3固体的质量为( )
| A. | 201.4 g | B. | 212.0 g | C. | 21.2 g | D. | 100.7 g |
2.甲、乙、丙、丁4种元素在周期表中的位置如下表所示,其中能形成两性氧化物的是( )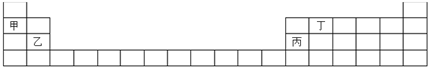

| A. | 元素甲 | B. | 元素乙 | C. | 元素丙 | D. | 元素丁 |
9.对如图所示实验装置的说明错误的是( )
| A. |  能作为SO2的干燥装置 | |
| B. |  验证铁钉的吸氧腐蚀 | |
| C. |  可用于测量Cu与浓硝酸反应生成NO2的体积 | |
| D. |  可证明酸性:H2SO4>H2CO3>H2SiO3 |
6.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1.00molNaCl固体中含有6.02×1023个NaCl分子 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
7.下列实验做法不正确的是( )
| A. | 用无水硫酸铜检验乙醇中是否含水 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 | |
| D. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 |
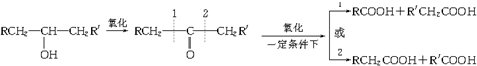
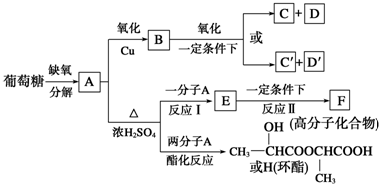
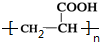 ,H
,H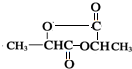 .
.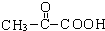 +2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
+2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.