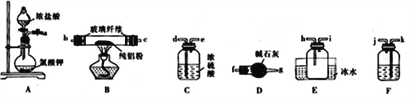
题目内容
【题目】下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有金属阳离子的晶体一定是离子晶体
D. 元素的非金属性越强,其单质的活泼性一定越强
【答案】A
【解析】试题分析:A、分子晶体中一定含有分子间作用力,但不一定含有共价键,如稀有气体分子中不含共价键,正确;B、分子中含有2个H原子的酸不一定是二元酸,如甲酸为一元酸,错误;C、含有金属阳离子的晶体还可能是金属晶体,错误;D、元素的非金属性越强,其单质的活泼性不一定越强,如N元素的非金属性大于P,但氮气比P单质稳定,错误,答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
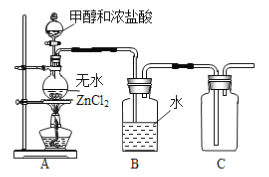
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为___________,如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____________。
②装置B的主要作用是____________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1 mL c1 mol·L-1 NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定,最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C—Cl | C—Br |
键能(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式______________。
②CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
③设计实验证明Ksp(AgCl)>Ksp(AgBr):___________(简要说明实验操作、现象和结论)。
【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2可用于生产甲醇,已知:2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1_______X2(填“>”或“<”,后同),Q_______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
③TK时,在该容积可变的恒压密闭容器中发生上述反应,测得有关数据如下表所示:
物质的量(mol) 时间(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
已知在10min时只改变了一个反应条件,用改变的条件可能是______。
④下列情况下能表明该反应达到平衡状态的是_____。
a.气体密度不变 b.混合气休的平均摩尔质量不变 c.消耗速率:2v(H2O)=v(CO2)
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
① 若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=______ [常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③
B.②③④
C.①③④
D.①②③④
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃