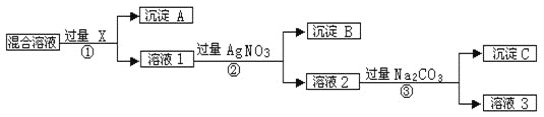
题目内容
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,且A、C同周期,B和C同主族;A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30;D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)C元素的元素符号为________;
(2)B、D元素的第一电离能大小关系为:B_____D(填“<”、“>”或“=”);
(3)写出D元素形成的单质的结构式为______________,其中σ键:π键=______。
(4)A2B对应的水化物的碱性比LiOH _______(填“强”或“弱”);化合物A2B2属于_______(选“离子”或“共价”)化合物,写出A2B2的电子式_________________,A2B2溶于水时发生反应的化学方程式为__________________________________________________
(5)化合物E2B、E2C,它们结构与组成相似,热稳定性更强的是__________(填化学式)
但E2B的沸点比E2C高得多的原因是___________________________________。
【答案】 S < N≡N 1:2 强 离子 ![]() 2Na2O2+2H2O=4NaOH+O2↑ H2O 水分子间存在氢键
2Na2O2+2H2O=4NaOH+O2↑ H2O 水分子间存在氢键
【解析】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝,则为氨气,故D为氮元素、E为氢元素; A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30,则A为钠元素、B为氧元素;A、C同周期,B和C同主族,则C为硫元素;(1)C为硫元素,元素符号为S;(2)N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是O<N;(3)N元素形成的单质N2的结构式为N≡N,其中σ键:π键=1:2;(4)同主族金属元素的最高价氧化物的水化物的碱性从上而下增强,故A2B对应的水化物NaOH的碱性比LiOH强;化合Na2O2属于离子化合物, 其电子式为![]() ,Na2O2溶于水时发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;(5)化合物H2O、H2S,它们结构与组成相似,非金属性越强氢化物的稳定性越强,故热稳定性更强的是H2O;但H2O的沸点比H2S高得多的原因是水分子间存在氢键。
,Na2O2溶于水时发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;(5)化合物H2O、H2S,它们结构与组成相似,非金属性越强氢化物的稳定性越强,故热稳定性更强的是H2O;但H2O的沸点比H2S高得多的原因是水分子间存在氢键。