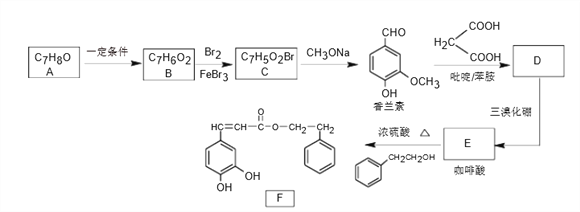
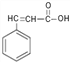
题目内容
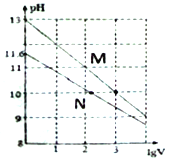
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
【答案】D
【解析】NaOH为强碱,常温下0.10mol/LNaOH溶液的pH=13,所以曲线M表示NaOH溶液的pH随lgV的变化关系,曲线N表示Na2CO3溶液的pH随lgV的变化关系;Na2CO3溶液中存在的水解主要是:CO32-+H2O![]() HCO3-+OH-,常温下0.10mol/L的Na2CO3溶液的pH=11.6,即c(H+)=10-11.6,则c(OH-)=Kw/c(H+)=10-2.4,Ka1(CO32-)=
HCO3-+OH-,常温下0.10mol/L的Na2CO3溶液的pH=11.6,即c(H+)=10-11.6,则c(OH-)=Kw/c(H+)=10-2.4,Ka1(CO32-)=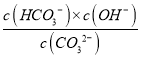 ≈
≈![]() =10-3.8,由上述分析,A、B都正确;C项,Na2CO3溶液中Na+和CO32-是主要离子,c(Na+)>c(CO32-),CO32-水解使溶液显碱性,则c(OH-)>c(H+),且c(H+)远小于c(OH-),因为水解是微弱的,所以c(CO32-)>c(OH-),又因为Na2CO3溶液中存在二级水解:CO32-+H2O
=10-3.8,由上述分析,A、B都正确;C项,Na2CO3溶液中Na+和CO32-是主要离子,c(Na+)>c(CO32-),CO32-水解使溶液显碱性,则c(OH-)>c(H+),且c(H+)远小于c(OH-),因为水解是微弱的,所以c(CO32-)>c(OH-),又因为Na2CO3溶液中存在二级水解:CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-,其中主要为第一级水解,所以c(OH-)略大于c(HCO3-),综上分析,Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故C正确;D项,Na2CO3溶液中存在水解:Na2CO3+H2O
H2CO3+OH-,其中主要为第一级水解,所以c(OH-)略大于c(HCO3-),综上分析,Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故C正确;D项,Na2CO3溶液中存在水解:Na2CO3+H2O![]() NaHCO3+NaOH,若将Na2CO3溶液加热蒸发,开始时温度升高促进水解,但随着水分的减少,NaHCO3和NaOH浓度增大,因为二者不能大量共存,所以又会反应生成Na2CO3,因此将Na2CO3溶液加热蒸干,最终析出的是Na2CO3固体,故D错误。
NaHCO3+NaOH,若将Na2CO3溶液加热蒸发,开始时温度升高促进水解,但随着水分的减少,NaHCO3和NaOH浓度增大,因为二者不能大量共存,所以又会反应生成Na2CO3,因此将Na2CO3溶液加热蒸干,最终析出的是Na2CO3固体,故D错误。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案