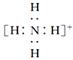题目内容
【题目】已知PbS、CuS、HgS的溶度积分别为9.0×10-29、1.3×10-36、4×10-53。下列说法正确的是
A. 硫化钠可作处理废水中含上述金属离子的沉淀剂
B. 在硫化铜悬浊液中滴几滴硝酸铅溶液,会生成硫化铅
C. 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当溶液中c(S2-)=0.001mol/L时三种金属离子不能都完全沉淀
D. 向含Pb2+、Cu2+、Hg2+的浓度均为0.010mol/L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
【答案】A
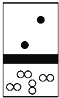
【解析】CuS、PbS、HgS为相同类型的难溶物,可以直接根据它们的溶度积判断溶解度大小,由CuS、PbS、HgS的溶度积可以知道,溶解度由大到小的顺序为HgS、CuS、PbS。硫化钠能够与Pb2+、Cu2+、Hg2+离子反应生成难溶物CuS、PbS、HgS,所以硫化钠是处理废水中含上述金属离子的沉淀剂,A正确;在硫化铜悬浊液中滴几滴硝酸铅溶液,因为硫化铜的溶度积小于硫化铅,所以硫化铜不能转化硫化铅,B错误; 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当![]() 时,各离子浓度分别为c(Hg2+)=6.4×10-20mol/L、c(Cu2+)=1.3×10-33mol/L、c(Pb2+)=9×10-26mol/L,三种金属离子浓度都小于
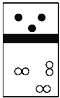
时,各离子浓度分别为c(Hg2+)=6.4×10-20mol/L、c(Cu2+)=1.3×10-33mol/L、c(Pb2+)=9×10-26mol/L,三种金属离子浓度都小于![]() ,所以
,所以![]() 、
、![]() 、
、![]() 离子都完全沉淀,C错误;CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶解度大小,根据题干信息可以知道,溶解度最小的、最难溶的为HgS,溶度积最大、最后生成沉淀的为PbS,所以产生沉淀的顺序依次为HgS、 CuS、PbS,D错误;正确选项A。
离子都完全沉淀,C错误;CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶解度大小,根据题干信息可以知道,溶解度最小的、最难溶的为HgS,溶度积最大、最后生成沉淀的为PbS,所以产生沉淀的顺序依次为HgS、 CuS、PbS,D错误;正确选项A。

【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:

(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。