题目内容
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42-和NO3﹣的相互分离。相应的实验过程可用下图表示:
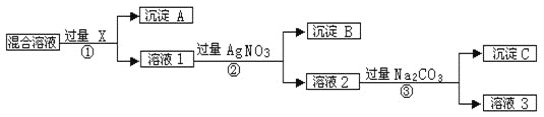
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___________,沉淀C______________。
(2)按此实验方案得到的溶液3中肯定含有杂质;为了解决这个问题,可以向溶液3中加入适量的____________。
(3)上述实验流程中加入过量的AgNO3,确认AgNO3已过量的实验方法是________________________。
(4)写出步骤①中发生反应的离子方程式是__________________________________。
【答案】BaCl2 或 Ba(NO3)2 Ag2CO3 和 BaCO3 HNO3 静置取上层清液继续滴加AgNO3溶液,若无沉淀则证明AgNO3溶液过量 Ba2++SO42-=BaSO4↓
【解析】
试题(1)Cl-用Ag+除去,SO42-用Ba2+除去,除杂分离不能引入新杂质,过量Ba2+、Ag+必须除去,根据实验过程,X为BaCl2或Ba(NO3)2,沉淀A为BaSO4;(2)根据实验过程,溶液1溶质为BaCl2或Ba(NO3)2、NaCl、NaNO3,②中加入AgNO3溶液,沉淀B为AgCl,溶液2溶质为NaNO3、Ba(NO3)2、NaNO3,反应③中加入过量的Na2CO3,沉淀C为BaCO3、AgCO3,溶液3为Na2CO3、NaNO3;(3)根据上述分析,Na2CO3作用除去过量的Ba2+、Ag+,确认Na2CO3过量操作:取少量溶液,置于试管中,向溶液中加入BaCl2溶液或盐酸,产生沉淀或气泡,则说明Na2CO3过量;(4)反应①中发生的反应Ba2++SO42-=BaSO4↓。

【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
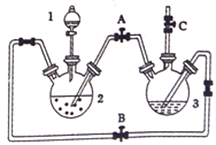
(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。