题目内容
【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
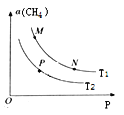
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
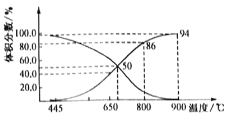
①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
【答案】![]()
![]() △H1+
△H1+![]() △H2+△H3Al4C3+l2H2O=4Al(OH)3↓+3CH4↑0.04mol·L-1·min-14cd7.5%14.73p总
△H2+△H3Al4C3+l2H2O=4Al(OH)3↓+3CH4↑0.04mol·L-1·min-14cd7.5%14.73p总
【解析】
(1)由乙烯的成键特点可得其分子的电子式为:![]() (2)①由盖斯定律可得目标热化学方程式可由
(2)①由盖斯定律可得目标热化学方程式可由 ![]() ,则△H4=
,则△H4=![]() △H1+
△H1+![]() △H2+△H3,故答案为:△H4=
△H2+△H3,故答案为:△H4=![]() △H1+
△H1+![]() △H2+△H3;②Al4C3与水反应发生强烈的水解生成Al(OH)3和CH4,故答案为:Al4C3+l2H2O=4Al(OH)3↓+3CH4↑(3)①0~20min内NO的浓度变化2.0mol/L-0.4mol/L=1.6mol/L,则CO2的浓度增加为1.6mol/L÷2=0.8mol/L,其平均反应速率v(CO2)=0.8mol/L÷20min=0.04mol·L-1·min-1,由反应方程式可得该反应的平衡常数K=
△H2+△H3;②Al4C3与水反应发生强烈的水解生成Al(OH)3和CH4,故答案为:Al4C3+l2H2O=4Al(OH)3↓+3CH4↑(3)①0~20min内NO的浓度变化2.0mol/L-0.4mol/L=1.6mol/L,则CO2的浓度增加为1.6mol/L÷2=0.8mol/L,其平均反应速率v(CO2)=0.8mol/L÷20min=0.04mol·L-1·min-1,由反应方程式可得该反应的平衡常数K=![]() =
=![]() =4, 故答案为:0.04mol·L-1·min-1、4;②30min时改变某一条件后,在第二次达到平衡后平衡常数K=
=4, 故答案为:0.04mol·L-1·min-1、4;②30min时改变某一条件后,在第二次达到平衡后平衡常数K=![]() =4,和第一次平衡时相同,则改变的条件不可能是温度,且在新平衡下,各物质的浓度都变为原来的1.5倍,则改变的条件只能在其它条件不变时将体积压缩到原来的
=4,和第一次平衡时相同,则改变的条件不可能是温度,且在新平衡下,各物质的浓度都变为原来的1.5倍,则改变的条件只能在其它条件不变时将体积压缩到原来的![]() 或在其它条件不变时又充入一定量的NO(为原起始NO物质的量的0.5倍),故答案为:cd;(4)①设CO2的转化率为x,则剩余CO2为(1-x)mol,生成CO为2xmol,CO2的体积分数=
或在其它条件不变时又充入一定量的NO(为原起始NO物质的量的0.5倍),故答案为:cd;(4)①设CO2的转化率为x,则剩余CO2为(1-x)mol,生成CO为2xmol,CO2的体积分数=![]() =0.86,解得x≈0.075,故答案为:7.5%;②由题示信息可得Kp=
=0.86,解得x≈0.075,故答案为:7.5%;②由题示信息可得Kp=![]() =0.942 P2总÷0.06 P2总=14.73p总,故答案为:14.73p总。
=0.942 P2总÷0.06 P2总=14.73p总,故答案为:14.73p总。

 53随堂测系列答案
53随堂测系列答案