题目内容
18.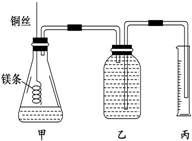 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:①配制100mL 1.0mol/L 的盐酸溶液;
②用10ml的量筒量取10.0mL 1.0mol/L 的盐酸溶液加入锥形瓶中;
③称取a g 已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为0.12;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题.
(1)用文字表述实验步骤④中检查装置气密性的方法:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好
(2)实验步骤⑤中应选用B(填序号)的量筒.
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意调节量筒高度,使量筒内的液面与集气瓶内的液面相平.
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为:Vm=0.2V L•mol-1,若未除去镁条表面的氧化膜,则测量结果偏小(填“偏大”、“偏小”或“无影响”).
分析 ③根据氯化氢的物质的量及化学方程式计算镁条的质量;
(1)根据压力差检验装置的气密性;
(2)步骤③假设a全部是镁,结合化学方程式计算得到;
Mg+2HCl═MgCl2+H2↑
24g 2mol 11200mL
0.12g 0.01mol 112mL
应选200mL量筒;读数时要保持左右气体压强相等,以减少误差,故应注意:将量筒缓缓向下移动,使乙、丙中液面相平;
(3)根据气体摩尔体积的计算式,Vm=$\frac{V}{n}$计算即可.
解答 解:10.0mL 1.0mol/L 的盐酸中含有氯化氢的物质的量为:1.0mol/L×0.01L=0.01mol,
③Mg+2HCl═MgCl2+H2↑
24g 2mol
a 0.01mol,
a=$\frac{24g×0.01mol}{2mol}$g,
故答案为:0.12;
(1)根据压力差检验装置的气密性,两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好,
故答案为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好;
(2)步骤③步骤③假设a全部是镁,则
Mg+2HCl═MgCl2+H2↑
24g 2mol 11200mL
0.12g 0.01mol 112mL
由方程可知:为使HCl全部参加反应,a的数值至少为0.12g;生成112mL氢气,应选200mL量筒;
读数时要保持左右气体压强相等,以减少误差,故应注意:将量筒缓缓向下移动,使乙、丙中液面相平,调节量筒高度,使量筒内的液面与集气瓶内的液面相平,
故答案为:B;调节量筒高度,使量筒内的液面与集气瓶内的液面相平;
(3)0.01mol氯化氢完全反应能够生成0.005mol氢气,该氢气的体积为VmL,若忽略水蒸气的影响,则在该实验条件下测得气体摩尔体积的计算式为:Vm=$\frac{V}{n}=\frac{V×1{0}^{-3}L}{0.005mol}$=0.2V L•mol-1;
若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小,
故答案为:0.2V L•mol-1;偏小.
点评 本题主要考查常温下气体摩尔体积的测定,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握气体摩尔体积的概念及计算方法,试题培养了学生的分析、理解能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9 kJ•mol-1,则CH3OH的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g);△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2800 kJ•mol-1,则1/2 C6H12O6 (s)+3O2 (g)═3CO2 (g)+3H2O ( l );△H=-1400 kJ•mol-1 |
| A. | 碳酸钙滴加盐酸:CO32-+2H+═CO2+H2 O | |
| B. | 氢氧化钡与硫酸反应:H++OH-═H2O | |
| C. | 氢氧化铜与硝酸反应Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
| A. | 标准状况下,1mol水的体积约为22.4L | |
| B. | 3.4gOH-中含有的电子的数目为0.2NA | |
| C. | 标准状况下,11.2 LCO2和SO2混合气体中含NA个氧原子 | |
| D. | 1mol氖气和1mol氧气体积相同 |
①既不溶于水又不溶于酸 ②对人体有较大毒性 ③不易被X射线透过 ④有治疗疾病的作用.
| A. | 只有① | B. | ①和③ | C. | ①和④ | D. | ②和③ |
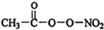 (PAN)等二次污染物.
(PAN)等二次污染物.
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.