题目内容
6.下列关于热化学反应的描述中正确的是( )| A. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)═CO2(g)+2H2(g);△H=-192.9 kJ•mol-1,则CH3OH的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g);△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2800 kJ•mol-1,则1/2 C6H12O6 (s)+3O2 (g)═3CO2 (g)+3H2O ( l );△H=-1400 kJ•mol-1 |
分析 A、H2SO4和Ba(OH)2反应,包括钡离子和硫酸根离子的热效应;
B、燃烧热是生成稳定的氧化物,氢生成液态水;
C、燃烧热是生成稳定的氧化物,氢生成液态水,所以应是2H2O(l)═2H2(g)+O2(g);△H=+571.6 kJ•mol-1;
D、依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式分析计算.
解答 解:A、H2SO4和Ba(OH)2反应,包括钡离子和硫酸根离子的热效应,所以H2SO4和Ba(OH)2反应的反应热应小于2×(-57.3)kJ•mol-1,故A错误;
B、燃烧热是生成稳定的氧化物,氢生成液态水,而不是氢气,故B错误;
C、燃烧热是生成稳定的氧化物,氢生成液态水,所以应是2H2O(l)═2H2(g)+O2(g);△H=+571.6 kJ•mol-1,故C错误;
D、依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以0.5mol放出的热量为:1400 kJ,热化学方程式为:1/2 C6H12O6 (s)+3O2 (g)═3CO2 (g)+3H2O ( l );△H=-1400 kJ•mol-1,故D正确;
故选D.
点评 本题考查了热化学方程式书写方法,燃烧热概念分析应用,化学反应与能量变化的计算关系,题目难度中等.

练习册系列答案
相关题目
15.下列有关物质用途的说法错误的是( )
| A. | 可用铝槽密闭盛装浓硫酸 | |
| B. | 工业上利用蛋白质的水解反应生产肥皂和甘油 | |
| C. | 乙醇可用作汽车燃料 | |
| D. | 食醋可用于消除暖水瓶中的水垢 |
16.下列有关化学用语不正确的是( )
| A. | 四氯化碳的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的球棍模型: | D. | 乙炔的结构简式:CH≡CH |

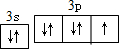
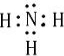 .
. ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.

 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: