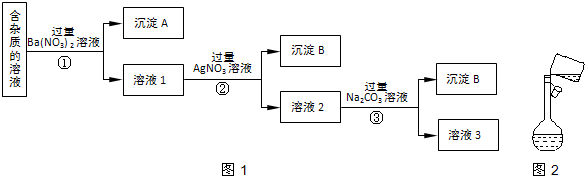
题目内容
8.(1)用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O═2HCl+H2SO4(2)在上述反应中,氧化剂是Cl2,还原剂是SO2;
(3)若反应消耗35.5gCl2,同时消耗标准状况下SO2的体积约为11.2L,转移电子物质的量为1mol.
分析 Cl2+SO2+2H2O═2HCl+H2SO4中,Cl元素的化合价降低,S元素的化合价升高,该反应转移2e-,以此来解答.
解答 解:(1)Cl2+SO2+2H2O═2HCl+H2SO4中,Cl元素的化合价降低,S元素的化合价升高,该反应转移2e-,则双线桥法表示下列反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(2)Cl元素的化合价降低,则Cl2为氧化剂,S元素的化合价升高,SO2为还原剂,故答案为:Cl2;SO2;
(3)若反应消耗35.5gCl2,其物质的量为$\frac{35.5g}{71g/mol}$=0.5mol,由反应可知,同时消耗标准状况下SO2的体积约为0.5mol×22.4L/mol=11.2 L,转移电子为0.5mol×(6-4)=1mol,故答案为:11.2;1.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析、应用及计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列有关物理量相应的单位错误的是( )
| A. | 摩尔质量g•mol-1 | B. | 物质的量浓度L•mol-1 | ||
| C. | 气体摩尔体积L•mol-1 | D. | 物质的量mol |
16.下列有关化学用语不正确的是( )
| A. | 四氯化碳的电子式: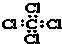 | B. | CH4分子的比例模型: | ||
| C. | 乙烯的球棍模型: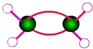 | D. | 乙炔的结构简式:CH≡CH |
13.关于同温同压下相同体积的CO和CO2,下列有关叙述不正确的是( )
| A. | 物质的量相等 | B. | 所含分子数相等 | ||
| C. | 质量相等 | D. | 所含碳原子数相等 |
20.下列说法中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应物能量大于生成物能量的是放热反应 | |
| C. | 反应物能量大于生成物能量的是吸热反应 | |
| D. | 化学反应中也存在着反应物能量与生成物能量相等的反应情况 |
18.下列措施能降低化学反应的活化能,提高反应速率的是( )
| A. | 增大反应物浓度 | B. | 加催化剂 | C. | 加压 | D. | 升温 |
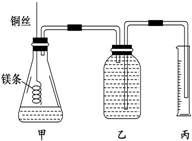 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: