题目内容
15.PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、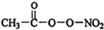 (PAN)等二次污染物.
(PAN)等二次污染物.①1mol PAN中含有的σ键数目为10NA(或6.02×1024).PAN中除H外其余三种元素的第一电离能由大到小的顺序为N>O>C.
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为6,中心离子的核外电子排布式为1s22s22p63s23p63d6(或[Ar]3d6).
③相同压强下,HCOOH的沸点比CH3OCH3高(填“高”或“低”),其原因是HCOOH分子间能形成氢键.
分析 (1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,据此答题;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,据此答题;
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键,据此答题.
解答 解:(1)①一个单键就是 一个σ键,一个双键中含有一个σ键和一个π键,根据分子的结构简式可知,一个PAN中共有11个共价键,所以1mol PAN中含有的σ键数目为10NA;
同周期元素,从左到右,元素的第一电离能逐渐增大,第ⅤA族的P轨道处于半充满状态,比同周期的相邻元素第一电离能高,所以第一电离能由大到小的顺序为:N>O>C,
故答案为:10NA (或6.02×1024);N>O>C;
②配位体位于方括号中,由1个NO和5个H2O分子构成,所以该配合物中中心离子的配位数为6;中心离子为Fe2+,铁是26号元素,则Fe2+的电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,
故答案为:6;1s22s22p63s23p63d6 (或[Ar]3d6);
③HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以在相同压强下,HCOOH的沸点比CH3OCH3高,
故答案为:高;HCOOH分子间能形成氢键.
点评 本题考查了配合物成键情况、第一电离能、氢键等知识,题目难度中等,明确配合物成键情况的判断方法为解答关键,注意掌握氢键、第一电离能的概念及应用方法.

练习册系列答案
相关题目
5.下列物质属于纯净物的是( )
| A. | 漂白粉 | B. | 盐酸 | C. | 氯水 | D. | 液氯 |
6.下列热化学方程式中,能够表示物质燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
20.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 铝罐可久盛食醋 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 铁表而镀锌可以增强其抗腐蚀性 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
7.某元素的离子带2个单位正电荷,它的核外电子排布为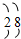 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )
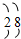 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
 .
.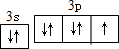 ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.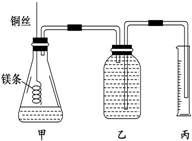 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: