题目内容
13.能下列离子方程式中,正确的是( )| A. | 碳酸钙滴加盐酸:CO32-+2H+═CO2+H2 O | |
| B. | 氢氧化钡与硫酸反应:H++OH-═H2O | |
| C. | 氢氧化铜与硝酸反应Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
分析 A.碳酸钙为沉淀,应保留化学式;
B.漏掉钡离子与硫酸根离子的反应;
C.反应生成硝酸铜和水;
D.电荷不守恒.
解答 解:A.碳酸钙滴加盐酸,离子方程式:CaCO3+2H+═CO2+H2O+Ca2+,故A错误;
B.氢氧化钡与硫酸反应,离子方程式:Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,故B错误;
C.氢氧化铜与硝酸反应离子方程式:Cu(OH)2+2H+═Cu2++2H2O,故C正确;
D.铝片插入硝酸汞溶液中,离子方程式:2Al+3Hg2+═2Al3++3Hg,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写是解题关键,题目难度不大.

练习册系列答案
相关题目
4.某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该同学完成实验报告.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
Ⅳ.实验结论:(3)Cl>Br>I.
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
5.下列关于新制氯水及久置氯水的说法,不正确的是( )
| A. | 新制的氯水呈黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
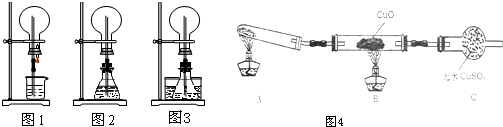
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回 答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: