题目内容
13.现有一种天然黄铜矿(主要成分为CuFeS2,含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如图1的实验: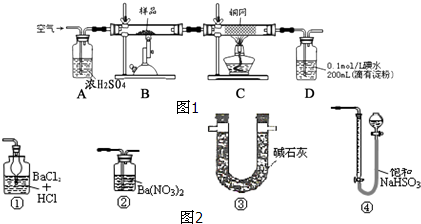
现称取研细的黄铜矿样品1.0g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取D中溶液的$\frac{1}{10}$置于锥形瓶中,用0.10mol/LNa2S2O3标准溶液进行滴定,用去20.00mL.已知化学方程式:I2+2Na2S2O3=2NaI+Na2S4O6.请回答下列问题:
(1)将黄铜矿研细所用仪器是研钵,称量样品所用的仪器为托盘天平.
(2)装置A的作用是bd(填序号).
a.有利于空气中氧气充分反应b.除去空气中的水蒸气c.有利于气体混合d.有利于观察空气流速
(3)写出装置B中发生反应的化学方程式3CuFeS2+8O2$\frac{\underline{\;煅烧\;}}{\;}$3Cu+Fe3O4+6SO2;装置D中发生反应的离子方程式I2+SO2+2H2O=4H++SO42-+2I-.
(4)上述反应结束后,仍需通一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确.
(5)判断滴定已达终点的现象是溶液由蓝色变化为无色且半分钟不变,证明反应达到终点.
(6)通过计算可知该黄铜矿的纯度为92%.
(7)若用图2装置替代上述实验装置D,同样可以准确测定黄铜矿纯度的是②(填序号).
分析 (1)增大固体的表面积可以加快化学反应速率,研磨仪器需要研钵,称量黄铜矿样品1.0g,依据精确度可知选择托盘天平;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(3)装置B中是天然黄铜矿(主要成分为CuFeS2,含少量脉石),在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,装置D中是吸收生成的二氧化硫气体,碘单质和二氧化硫反应生成碘化氢和硫酸;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)用0.10mol/LNa2S2O3标准溶液进行滴定,用去20.00mL.已知化学方程式:I2+2Na2S2O3=2NaI+Na2S4O6,选取淀粉作指示剂,滴入最后一滴溶液由蓝色变化为无色且半分钟不变,证明反应达到终点;
(6)根据滴定过程分析,用0.10mol/LNa2S2O3标准溶液进行滴定,用去20.00mL.已知化学方程式:I2+2Na2S2O3=2NaI+Na2S4O6,计算剩余碘单质,得到生成二氧化硫物质的量,利用硫元素物质的量守恒计算CuFeS2质量,得到质量分数;
(7)装置D的作用是吸收前边实验产生的二氧化硫,根据实验目的以及仪器的作用来回答;
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)将样品在研钵中研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,称量黄铜矿样品1.0g,依据精确度可知选择托盘天平,
故答案为:研钵;托盘天平;
(2)装置A中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量,故答案为:bd;
(3)装置B中是天然黄铜矿(主要成分为CuFeS2,含少量脉石),在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,反应的化学方程式为3CuFeS2+8O2$\frac{\underline{\;煅烧\;}}{\;}$3Cu+Fe3O4+6SO2,装置D中是吸收生成的二氧化硫气体,碘单质和二氧化硫反应生成碘化氢和硫酸,反应的离子方程式为I2+SO2+2H2O=4H++SO42-+2I-,
故答案为:3CuFeS2+8O2$\frac{\underline{\;煅烧\;}}{\;}$3Cu+Fe3O4+6SO2;I2+SO2+2H2O=4H++SO42-+2I-;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)用0.10mol/LNa2S2O3标准溶液进行滴定,用去20.00mL.已知化学方程式:I2+2Na2S2O3=2NaI+Na2S4O6,选取淀粉作指示剂,滴入最后一滴溶液由蓝色变化为无色且半分钟不变,证明反应达到终点;
故答案为:溶液由蓝色变化为无色且半分钟不变,证明反应达到终点;
(6)根据滴定过程分析,实验后取D中溶液的$\frac{1}{10}$置于锥形瓶中,用0.10mol/LNa2S2O3标准溶液进行滴定,用去20.00mL.已知化学方程式:I2+2Na2S2O3=2NaI+Na2S4O6,计算剩余碘单质物质的量n(I2)=$\frac{1}{2}$×0.10mol/L×0.0200L×10=0.01mol,与二氧化硫反应的碘单质物质的量=0.1mol/L×0.2L-0.01mol=0.01mol,I2+SO2+2H2O=4H++SO42-+2I-,得到生成二氧化硫物质的量为0.01mol,利用硫元素物质的量守恒,得到:2SO2~CuFeS2,所以黄铜矿的质量是:0.5×0.010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.0g}$×100%=92%,故答案为:92%;
(7)用如图2装置替代上述实验装置d,因为硝酸钡溶液会和二氧化硫发生反应,所以根据产生沉淀的量计算二氧化硫生成的量,进而根据元素守恒来确定黄铜矿的纯度,故选②,
故答案为:②.
点评 本题考查了物质组成和含量的实验测定方法和计算分析应用,主要考查学生分析和解决问题的能力,掌握滴定实验的计算和实验基本操作是解题关键,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
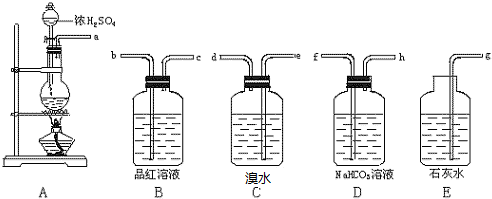
小学生10分钟应用题系列答案 电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )| A. | d点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| B. | 电导率传感器能用于酸碱中和滴定终点的判断 | |
| C. | c点电导率最小是因为c点溶液的溶质为弱电解质 | |
| D. | c(Na+)、c(Cl-)对导电能力的影响比c(H+)、c(OH-)对导电能力的影响小 |
| A. | CaCl2 | B. | NaOH | C. | H2O | D. | Na2O |
| A. | 向Ba(NO3)2溶液中通入CO2不产生白色沉淀,则通入SO2也不产生白色沉淀 | |
| B. | 电负性:C<N<O,则第一电离能:C<N<O | |
| C. | 乙醛能被新制Cu(OH)2氧化,则乙醛也能被溴水氧化 | |
| D. | HBr的沸点小于HI的沸点,则HBr的稳定性小于HI的稳定性 |
| A. | 新型催化剂 | B. | 新型农药 | ||
| C. | 半导体材料 | D. | 耐腐蚀的合金材料 |
| A. | SO2为0.3 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO3SO2各为0.15 mol•L-1 | |
| C. | O2为0.05 mol•L-1 | |
| D. | SO3为0.3 mol•L-1 |
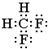 ;下列对于乙的描述正确的是d.
;下列对于乙的描述正确的是d.