题目内容
3.反应:2SO2+O2?2SO3在一定条件下的密闭容器中进行.已知反应的某一时间SO2、O2、SO3浓度分别为0.1mol•L-1、0.1mol•L-1、0.2mol•L-1,当达到平衡时,可能存在的数据为( )| A. | SO2为0.3 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO3SO2各为0.15 mol•L-1 | |
| C. | O2为0.05 mol•L-1 | |
| D. | SO3为0.3 mol•L-1 |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.3mol/L,O2小于0.2mol/L,故A错误;
B.SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,该题中实际变化为0.05mol/L,小于0.2mol/L,故B正确;
C.O2为0.05 mol•L-1,说明SO2完全反应,故C错误;
D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫完全反应,SO3的浓度的浓度变化为0.1mol/L,实际变化应小于该值,故D错误;
故选B.
点评 本题考查了化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,题目不难.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.7.4g某饱和一元醇X与足量金属Na反应,产生标准状况下H2 1.12L,则饱和一元醇X的可能结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
11.红辣椒中含有多种色泽鲜艳的天然色素,其中呈深红色的色素是辣椒红.依据下列结构简式判断,下列说法中正确的是( )
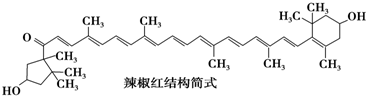

| A. | 不能发生氧化反应 | B. | 属于芳香族化合物 | ||
| C. | 能发生消去反应 | D. | 分子中含有11个碳碳双键 |
18.下列说法中不正确的是( )
| A. | 已知C+CO2═2CO是吸热反应,当温度升高时,v正增大,v逆减少 | |
| B. | 两个非金属原子之间形成的化学键一定是共价键 | |
| C. | 含有离子键的物质不可能是单质 | |
| D. | 单质中不一定含有共价键 |
8.下列说法正确的是( )
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 红外光谱图的研究可以确定有机物的相对分子质量 | |
| C. | 测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的 | |
| D. | 铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素 |
12.含有下列离子的溶液中分别加入NaOH固体,能引起该离子浓度减小(溶液体积不变)的是( )
| A. | Cl- | B. | CO32- | C. | HCO3- | D. | AlO2- |
13.下列有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 苯的分子式C6H6 | D. | 四氯化碳的电子式 |
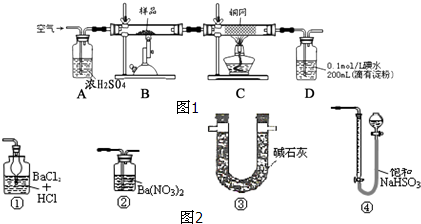
 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.