题目内容
5.A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.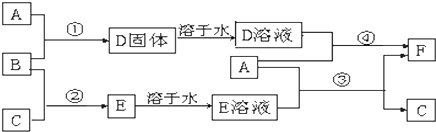
请回答:
(1)写出B物质的化学式:Cl2.
(2)写出第③步反应的化学方程式为Fe+2HCl=FeCl2+H2↑.
(3)第④步反应的离子方程式是2Fe3++Fe=3Fe2+.
(4)写出SO2在水中与B反应的离子方程式SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(5)F溶液中滴入NaOH溶液可能产生的实验现象是先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色.
分析 A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B是常见气体单质,且具有强氧化性,所以B应为Cl2,依次推出D为FeCl3,F为FeCl2;结合转化关系图可知,Fe和E溶液反应生成FeCl2和C,则E为HCl,C为H2,最后结合化学用语及反应的现象来解答.
解答 解:A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B是常见气体单质,且具有强氧化性,所以B应为Cl2,依次推出D为FeCl3,F为FeCl2;结合转化关系图可知,Fe和E溶液反应生成FeCl2和C,则E为HCl,C为H2,
(1)由上述推断可知,B为Cl2,故答案为:Cl2;
(2)第③步反应为Fe与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(3)第④步反应为Fe与氯化铁反应生成氯化亚铁,离子反应为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)B为Cl2,与SO2反应生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(5)F为FeCl2,其溶液中滴入NaOH溶液反应生成氢氧化亚铁白色沉淀,最终被氧化物红褐色的氢氧化铁沉淀,观察到现象为先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色,
故答案为:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色.
点评 本题考查无机物的推断,利用物质的性质及转化关系图来推断物质是解答的关键,注意A、D为解答本题的突破口,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
16.下列各组离子在给定条件下能大量共存的是( )
| A. | 能使酚酞试液变红的溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | c(H+):c(OH-)=105:1的溶液中:K+、HCO3-、Cl-、Na+ | |
| C. | c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、Al(OH)4-、CO32- | |
| D. | 强酸性溶液中:NH4+、I-、Fe2+、NO3- |
13.N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第四周期第VIIA族;Na和O形成1:1的化合物的电子式: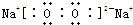 .该物质含有的化学键为:离子键和非极性键.
.该物质含有的化学键为:离子键和非极性键.
(2)用“>”或“<”填空:
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr$?_{放电}^{充电}$3Na2S2+Br2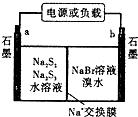
①放电时Na+向b极迁移(填“a或b,”).
②放电时负极的电极反应式为:3S22--2e-=2S32-
(4)已知N4为正四面体结构,N-N键能为167kJ•mol-1,N≡N键能为942kJ•mol-1.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
(1)Br位于元素周期表第四周期第VIIA族;Na和O形成1:1的化合物的电子式:
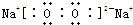 .该物质含有的化学键为:离子键和非极性键.
.该物质含有的化学键为:离子键和非极性键.(2)用“>”或“<”填空:
| 稳定性 | 粒子半径 | 熔点 | 键的极性 |
| NH3<H2O | O2-> Mg2+ | SO3< Na2O2 | H-O> H-N |

①放电时Na+向b极迁移(填“a或b,”).
②放电时负极的电极反应式为:3S22--2e-=2S32-
(4)已知N4为正四面体结构,N-N键能为167kJ•mol-1,N≡N键能为942kJ•mol-1.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
20.下列实验操作的描述符合实验事实的是( )
| A. | 中和滴定实验中,滴定管和锥形瓶都要先洗涤、再润洗 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | 分馏时,温度计的水银球插入液面以下 | |
| D. | 除去KNO3中的NaCl杂质,可用溶解→加AgNO3溶液→过滤方法 |
10.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| B. | 100g质量分数为36.5%的浓盐酸中所含HCl分子数为NA | |
| C. | 标况下,11.2LBr2含有的分子数为0.5 NA | |
| D. | 4.6gNa与100mL含0.1molHCl的盐酸溶液反应,转移电子数目为0.2NA |
17.下列各金属作还原剂时,还原性最强的是( )
| A. | Al | B. | Fe | C. | Cu | D. | Na |
14.亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2.下列有关说法错误的是( )
| A. | NaNO2既具有氧化性又具有还原性 | |
| B. | 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 | |
| C. | NaNO2和胃酸作用的离子方程式为:2NO2-+2H+═NO↑+NO2↑+H2O | |
| D. | 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol |
15.在恒容密闭容器中投入1mol X(g)、2mol Y(g)进行如下反应:X(g)+2Y(g)?2W(g)△H,X的浓度与温度关系如图所示,下列判断不正确的是( )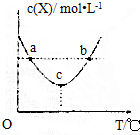
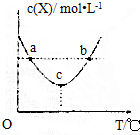
| A. | 上述反应中,△H<0 | |
| B. | c点时,消耗Y和W的速率相等 | |
| C. | 正反应速率:a<b | |
| D. | ac段,升高温度,平衡向正反应方向移动 |