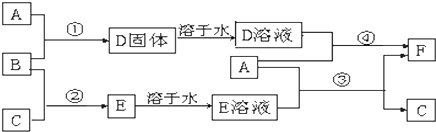
题目内容
15.在恒容密闭容器中投入1mol X(g)、2mol Y(g)进行如下反应:X(g)+2Y(g)?2W(g)△H,X的浓度与温度关系如图所示,下列判断不正确的是( )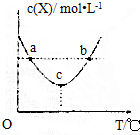
| A. | 上述反应中,△H<0 | |
| B. | c点时,消耗Y和W的速率相等 | |
| C. | 正反应速率:a<b | |
| D. | ac段,升高温度,平衡向正反应方向移动 |
分析 根据图知,随着温度升高,X浓度先减小后增大,说明c点之前,反应向正反应方向移动,导致c(X)降低;c点后继续升高温度,c(X)升高,说明升高温度平衡逆向移动,则c点是平衡点,正反应是放热反应,温度越高反应速率越大,据此分析解答.
解答 解:根据图知,随着温度升高,X浓度先减小后增大,说明c点之前,反应向正反应方向移动,导致c(X)降低;c点后继续升高温度,c(X)升高,说明升高温度平衡逆向移动,则c点是平衡点,正反应是放热反应,△H<0,温度越高反应速率越大,
A.根据以上分析知,正反应是放热,△H<0,故A正确;
B.通过以上分析知,c点是平衡点,同一物质的正逆反应速率相等,Y、Z的计量数相等,所以消耗Y和W的速率相等,故B正确;
C.温度越高反应速率越大,温度a<b,所以正反应速率a<b,故C正确;
D.分析温度对化学平衡移动影响应该在可逆反应达到平衡后分析,c点之前不是平衡状态,不能据此判断温度与平衡移动关系,故D错误;
故选D.
点评 本题考查化学平衡移动影响,为高频考点,正确判断平衡点是解本题关键,易错选项是D,只有可逆反应达到平衡状态时才能根据温度与平衡移动关系判断反应热,题目难度不大.

练习册系列答案
相关题目
6.下列各组中的两种固态物质熔化(或气化)时,克服的微粒间相互作用力属于同种类型的是( )
| A. | 碘和氯化钾 | B. | 金刚石和重晶石 | ||
| C. | 二氧化硅和干冰 | D. | 软脂酸甘油酯和冰醋酸 |
3.常温下,某溶液中由水电离出的c(H+)=10-12mol/L,则该溶液中一定不能大量存在的离子组是( )
| A. | Cu2+、NO3-、Cl-、Na+ | B. | NH4+、Mg2+、NO3-、SO42- | ||
| C. | K+、Ca2+、HCO3-、Cl-、 | D. | Cl-、SO42-、K+、Na+ |
10.某实验装置如图所示,下列叙述正确的是( )


| A. | K与M、N均断开时,不发生任何化学反应 | |
| B. | K分别与M、N相连时,铜电极的质量都会增加 | |
| C. | K与N相连时,溶液中的Cl-向铜电极移动 | |
| D. | K与M相连时,Fe电极表面有铜析出 |
20.下列烷烃的诸多同分异构体中,某种同分异构体的一氯代物可以只有一种,这种烷烃是( )
| A. | 正二十一烷 | B. | 正二十五烷 | C. | 正二十六烷 | D. | 正二十七烷 |
2.纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如图是利用海水制盐的副产品制备纳米氧化镁的流程图.
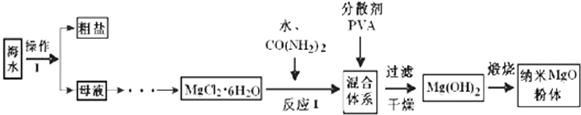
(1)操作I包括蒸发结晶、过滤.
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol•L-1,要使镁离子产生沉淀,溶液的pH最低应为10.(已知:Ksp[Mg(OH)2]=1.8×10-11)
(3)反应I中CO(NH2)2与H20反应生成C02和NH3•H20,还发生另一主要化学反应的离子方程式为Mg2++2NH3•H20=Mg(OH)2↓+2NH4+.
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表:
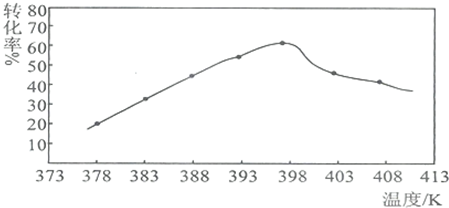
(5)如图为反应的温度对纳米MgO产率的影响.请归纳出温度对纳米MgO产率的影响规律其他条件相同时,在378K~398K,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低.(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低).

(1)操作I包括蒸发结晶、过滤.
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol•L-1,要使镁离子产生沉淀,溶液的pH最低应为10.(已知:Ksp[Mg(OH)2]=1.8×10-11)
(3)反应I中CO(NH2)2与H20反应生成C02和NH3•H20,还发生另一主要化学反应的离子方程式为Mg2++2NH3•H20=Mg(OH)2↓+2NH4+.
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表:
| 实验编号 | T/K | 反应时间/h | 反应物的物质的量配比n[CO(NH2)2]:n[MgCl2.6H2O] | 实验目的 |
| ① | 378 | 3 | 3:1 | (I)实验①和③探究反应物的物质的量配比对产率的影响 (II)实验②和④探究温度对产率的影响 (III)实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

19.如表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:rS2->rCl->rO2-.比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:rS2->rCl->rO2-.比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.