题目内容
15.化学电池在通讯、交通及日常生活中有着广泛的应用.(1)锌锰干电池是应用最普遍的电池之一(如图1所示),锌锰干电池的负极材料是锌,负极发生的电极反应方程式为:Zn-2e-=Zn2+.若反应消耗16.25g 负极材料,则电池中转移电子的物质的量为0.5mol.
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:
Cd+2NiO(OH)+2H2O$?_{放电}^{充电}$2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2
均难溶于水,但能溶于酸,以下说法中正确的是B.
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③B.②④C.①④D.②③
(3)图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的负(填“正”或“负”)极,Y极的电极反应方程式为O2+2H2O+4e-═4OH-.
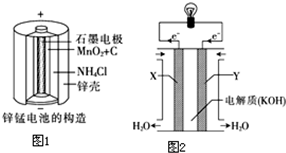
分析 (1)负极发生氧化反应,锌失电子;根据1mol的锌失去2mol的电子进行计算;
(2)该电池放电时为原电池,充电时为电解池,根据反应条件是否相同判断是否为可逆反应;
(3)根据负极反应为2H2-4e-+4OH-=2H2O,则通入氢气的一极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极发生还原反应,电极反应为O2-4e-+2H2O=4OH-,据此分析.
解答 解:(1)负极发生氧化反应,锌失电子,电极反应式为:Zn-2e-=Zn2+,16.25g锌是0.25mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为0.5mol,
故答案为:锌;Zn-2e-=Zn2+;0.5;
(2)①因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故错误;
②因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故正确;
③该电池充电时,电能转变为化学能,故错误;
④该电池放电时,是将化学能转化为电能,故正确;
故选B;
(3)X极的电极反应式为2H2-4e-+4OH-=2H2O,则通入氢气的X极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极Y极发生还原反应,电极反应为O2-4e-+2H2O=4OH-;故答案为:负;O2+2H2O+4e-═4OH-.
点评 本题考查原电池以及氢氧燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.

练习册系列答案
相关题目
5.下列措施不能达到节能减排目的是( )
| A. | 利用太阳能制氢燃料 | B. | 多乘坐公交车少开私家车 | ||
| C. | 利用燃烧煤发电 | D. | 用节能灯代替白炽灯 |
4.在pH=13的无色溶液中,可以大量共存的一组离子是( )
| A. | NH+4、NO3、K+、SO2-4 | B. | Fe3+、HCO3-、Cl-、Na+ | ||
| C. | Al(OH)-4、CO2-3、K+、Cl- | D. | SO2-4、Na+、Cu2+、NO-3 |
 (写出分子式)C9H10
(写出分子式)C9H10