题目内容
5.现有6种短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的$\frac{1}{5}$ |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是
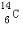 .
.(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
分析 W是周期表中原子半径最小的元素,故W为氢;地壳中含量最多的金属元素为铝,故U为铝;R的单质占空气体积的1/5,即R为O元素;T层上有6个电子,故T为硫;X的最外层电子数是次外层电子数的2倍,故X为碳;Y的氢化物水溶液呈碱性,故Y为氮元素;Z元素最高正价是+7价,故Z为Cl元素,据此进行解答.
解答 解:W是周期表中原子半径最小的元素,故W为H;地壳中含量最多的金属元素为Al,故U为Al;R的单质占空气体积的1/5,即R为O元素;T层上有6个电子,故T为S元素;X的最外层电子数是次外层电子数的2倍,故X为C元素;Y的氢化物水溶液呈碱性,故Y为N元素;Z元素最高正价是+7价,故Z为Cl元素,
(1)元素T为硫,S的原子核外共有16个电子,元素C的一种核素其中子数比质子数多2,这种核素的符号为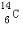 ,
,
故答案为:16;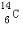 ;
;
(2)①元素N与元素H形成的离子NH4+与NaOH溶液共热反应生成氨气和水,离子反应方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
②元素Al的单质与NaOH溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素Cl与元素S相比,非金属性较强的是Cl,
a.常温下Z的单质和T的单质状态不同
,状态与非金属性无关,故a错误;
b.Z的氢化物比T的氢化物稳定,气态氢化物越稳定,说明非金属性越强,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,都能反应,不能说明强弱,故c错误,故选b,
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3;H2CO3是弱酸,其余均为强酸.
点评 本题考查结构性质位置关系、核外电子排布规律、元素周期律等知识,题目难度中等,推断元素是解题关键,注意基础知识的理解掌握,试题培养了学生的分析能力及灵活应用能力.

| A. | Na、Mg与水反应产生碱和氢气,Fe与在一定条件下水反应也生成碱和氢气 | |
| B. | CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑;则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ | |
| C. | Fe能置换硫酸铜溶液的铜;则Na也能置换硫酸铜溶液的铜 | |
| D. | 工业上电解熔融MgCl2的制取金属镁;则也可以用电解熔融AlCl3的制取金属铝 |
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 结合质子能力:Cl->S2- |
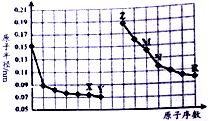
| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Ba与水反应会更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | ⅣA族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | m=5,n=l | B. | m=3,n=5 | C. | m=3,n=4 | D. | m=3,n=6 |
| A. | V(N2)=0.2mol•L-1•min-1 | B. | V(H2)=0.1mol•L-1•min-1 | ||
| C. | V(NH3)=0.4mol•L-1•min-1 | D. | V(H2)=0.3mol•L-1•min-1 |
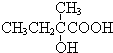
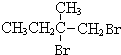 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$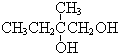 +2NaBr,反应类型取代反应
+2NaBr,反应类型取代反应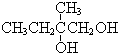 +O2+O2$\stackrel{催化剂}{→}$2
+O2+O2$\stackrel{催化剂}{→}$2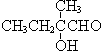 +2H2O,反应类型氧化反应
+2H2O,反应类型氧化反应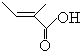 、
、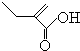 .
.