题目内容
20.下列有关物质性质的说法错误的是( )| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 结合质子能力:Cl->S2- |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.同一周期元素,原子半径随着原子序数增大而减小;
C.同一元素含氧酸中,非羟基O原子个数越多其酸性越强;
D.酸越弱,对应的阴离子越易结合质子.
解答 解:A.非金属性:Cl>I,元素的非金属性越强,对应的氢化物越稳定,故A正确;
B.同周期元素从左到右原子半径逐渐减小,则原子半径:Na>Mg,故B正确;
C.同一元素含氧酸中,非羟基O原子个数越多其酸性越强,所以酸性H2SO4>H2SO3,故C正确;
D.酸性HCl>H2S,酸越弱,对应的阴离子越易结合质子,所以结合质子能力:Cl-<S2-,故D错误;
故选D.
点评 本题考查同一周期、同一主族元素原子结构及性质递变规律,侧重考查学生分析判断能力,注意基础知识的积累和运用,题目难度不大.

练习册系列答案
相关题目
10.分析表中数据,回答下列问题:
海水在浓缩过程中析出盐的种类和质量(单位g/L)
(1)普通海水的密度是1.026g/mL,在常温下,随着水分的蒸发,会增大的是ab(选填编号).
a.NaCl的浓度 b.海水的密度 c.盐类的溶解度 d.MgCl2的溶解度
(2)当海水密度达到1.13g/mL时,首先析出的盐是CaSO4,主要原因是a(选填编号).
a.CaSO4的溶解度最小 b.CaSO4的浓度最小 c.CaSO4的含量最高 d.CaSO4的溶解度最大
(3)为了使粗盐中除氯化钠外,含杂质较少,实际生产中卤水的密度控制的范围是1.21~1.26g/mL
(4)粗盐中所含的杂质离子有Mg2+、SO42-、Ca2+,现用BaCl2、NaOH、Na2CO3、HCl精制食盐水,其试剂的滴加顺序是BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl.
(5)食盐是重要的化工原料,写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑; 阳极的产物是Cl2,检验的方法是使湿润的碘化钾淀粉试纸变蓝.工业上将该产物与消石灰反应制得漂粉精,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.将电解产物氢气和氯气结合,生成氯化氢,溶于水即得盐酸,写出盐酸的电离方程式HCl=H++Cl-.
(6)在实验室用加热食盐浓硫酸的方法来制取氯化氢气体,写出在微热条件下反应的化学方程式NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.制得的氯化氢气体可做“喷泉”实验,利用同样的装置再举出一组可形成“喷泉”的气体与液体NH3和H2O.
海水在浓缩过程中析出盐的种类和质量(单位g/L)
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
a.NaCl的浓度 b.海水的密度 c.盐类的溶解度 d.MgCl2的溶解度
(2)当海水密度达到1.13g/mL时,首先析出的盐是CaSO4,主要原因是a(选填编号).
a.CaSO4的溶解度最小 b.CaSO4的浓度最小 c.CaSO4的含量最高 d.CaSO4的溶解度最大
(3)为了使粗盐中除氯化钠外,含杂质较少,实际生产中卤水的密度控制的范围是1.21~1.26g/mL
(4)粗盐中所含的杂质离子有Mg2+、SO42-、Ca2+,现用BaCl2、NaOH、Na2CO3、HCl精制食盐水,其试剂的滴加顺序是BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl.
(5)食盐是重要的化工原料,写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑; 阳极的产物是Cl2,检验的方法是使湿润的碘化钾淀粉试纸变蓝.工业上将该产物与消石灰反应制得漂粉精,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.将电解产物氢气和氯气结合,生成氯化氢,溶于水即得盐酸,写出盐酸的电离方程式HCl=H++Cl-.
(6)在实验室用加热食盐浓硫酸的方法来制取氯化氢气体,写出在微热条件下反应的化学方程式NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.制得的氯化氢气体可做“喷泉”实验,利用同样的装置再举出一组可形成“喷泉”的气体与液体NH3和H2O.
11.有一包白色固体(一种二元酸的正盐),下表为进行相关实验的部分实验报告.
(1)请根据实验现象,将你作出的判断填在表格内的相应位置.
(2)若想确认此白色固体的成分,应在步骤②(填步骤序号)中加入试剂A,试剂A为盐酸.
(3)在此实验中所使用仪器为普通玻璃,其组成可以用氧化物的形式来表示:Na2O•CaO•6SiO2,制造这种玻璃的原料是石灰石、纯碱和石英.若每天要生产10t玻璃,石灰石的利用率为80%计算,纯碱和石英的利用率按95%计算,每天至少需要纯碱和石灰石的质量是多少?(写出计算过程,计算结果保留两位有效数字)
(1)请根据实验现象,将你作出的判断填在表格内的相应位置.
| 步骤序号 | 操作 | 实验现象 | 判 断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填离子符号) |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有NH4+ (填离子符号) |
| 结论:此白色固体可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
(3)在此实验中所使用仪器为普通玻璃,其组成可以用氧化物的形式来表示:Na2O•CaO•6SiO2,制造这种玻璃的原料是石灰石、纯碱和石英.若每天要生产10t玻璃,石灰石的利用率为80%计算,纯碱和石英的利用率按95%计算,每天至少需要纯碱和石灰石的质量是多少?(写出计算过程,计算结果保留两位有效数字)
5.现有6种短周期元素的性质或原子结构如下表:
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是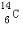 .
.
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的$\frac{1}{5}$ |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是
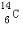 .
.(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
12.下列说法正确的是( )
| A. | CH2=CH2和CH3CH2Cl都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | C3H6有三种同分异构体 | D. | 苯的硝化反应属于取代反应 |
9.下列说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 纤维素属于高分子化合物,与淀粉互为同分异构体 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲酸分子中有醛基,因此无法区別甲醛溶液和甲酸溶液 |
7.下列有关金属的冶炼说法正确的是( )
| A. | 高炉炼铁的过程是通过置换反应得到铁 | |
| B. | 用直接加热氧化铝的方法冶炼得到铝 | |
| C. | 高温加热氧化镁和碳的混合物可以制单质镁 | |
| D. | 硫化亚铜与氧气反应炼铜的过程不属于氧化还原反应 |
 如图是某学生绘制的实验室蒸馏石油的装置图:
如图是某学生绘制的实验室蒸馏石油的装置图: