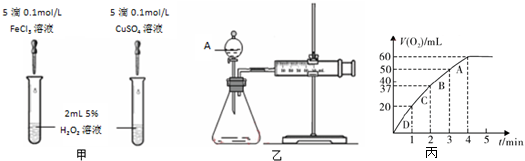
题目内容
15.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列说法正确的是( )| A. | Na、Mg与水反应产生碱和氢气,Fe与在一定条件下水反应也生成碱和氢气 | |
| B. | CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑;则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ | |
| C. | Fe能置换硫酸铜溶液的铜;则Na也能置换硫酸铜溶液的铜 | |
| D. | 工业上电解熔融MgCl2的制取金属镁;则也可以用电解熔融AlCl3的制取金属铝 |
分析 A.Fe和水蒸气在高温下反应生成四氧化三铁和氢气;
B.碳化钙和水反应属于复分解反应,该反应中没有电子转移,Al4C3和水反应生成氢氧化铝和烃,且没有电子转移;
C.钠性质很活泼,投入盐溶液反应时先和水反应;
D.熔融状态下氯化铝不导电.
解答 解:A.Fe和水蒸气在高温下反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故A错误;
B.碳化钙和水反应属于复分解反应,该反应中没有电子转移,Al4C3和水反应生成氢氧化铝和烃,且没有电子转移,碳化铝中C元素化合价为-4价,则生成的烷烃为甲烷,反应方程式为Al4C3+12H2O═4Al(OH)3↓+3CH4↑,故B正确;
C.钠性质很活泼,投入盐溶液反应时先和水反应,生成的NaOH再和硫酸铜发生分解反应生成氢氧化铜,反应方程式为2Na+CuSO4+2H2O=Cu(OH)2+H2↑+Na2SO4,所以钠不能置换出硫酸铜溶液中的Cu,故C错误;
D.氯化铝是共价化合物,在熔融状态下以分子存在,所以熔融状态下氯化铝不导电,用电解熔融氧化铝方法冶炼Al,故D错误;
故选B.
点评 本题考查探究化学规律,侧重考查元素化合物性质,注意规律中的反常现象是解本题关键,易错选项是D,注意不能采用电解熔融氯化铝冶炼Al的原因,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
5.除去下列括号内杂质的试剂和方法错误的是( )
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | C2H5OH(水),加足量CaO,蒸馏 |
6. 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.则该溶液中确定含有的离子是H+、Al3+、NH4+,一定不含有的阳离子是Mg2+、Fe2+、Fe3+,一定不存在的阴离子是ClO-、AlO2-.
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
3.按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是( )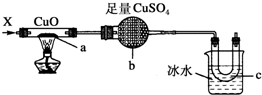

| A. | H2 | B. | CO和H2 | C. | NH3 | D. | CH3CH2OH(气) |
10.分析表中数据,回答下列问题:
海水在浓缩过程中析出盐的种类和质量(单位g/L)
(1)普通海水的密度是1.026g/mL,在常温下,随着水分的蒸发,会增大的是ab(选填编号).
a.NaCl的浓度 b.海水的密度 c.盐类的溶解度 d.MgCl2的溶解度
(2)当海水密度达到1.13g/mL时,首先析出的盐是CaSO4,主要原因是a(选填编号).
a.CaSO4的溶解度最小 b.CaSO4的浓度最小 c.CaSO4的含量最高 d.CaSO4的溶解度最大
(3)为了使粗盐中除氯化钠外,含杂质较少,实际生产中卤水的密度控制的范围是1.21~1.26g/mL
(4)粗盐中所含的杂质离子有Mg2+、SO42-、Ca2+,现用BaCl2、NaOH、Na2CO3、HCl精制食盐水,其试剂的滴加顺序是BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl.
(5)食盐是重要的化工原料,写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑; 阳极的产物是Cl2,检验的方法是使湿润的碘化钾淀粉试纸变蓝.工业上将该产物与消石灰反应制得漂粉精,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.将电解产物氢气和氯气结合,生成氯化氢,溶于水即得盐酸,写出盐酸的电离方程式HCl=H++Cl-.
(6)在实验室用加热食盐浓硫酸的方法来制取氯化氢气体,写出在微热条件下反应的化学方程式NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.制得的氯化氢气体可做“喷泉”实验,利用同样的装置再举出一组可形成“喷泉”的气体与液体NH3和H2O.
海水在浓缩过程中析出盐的种类和质量(单位g/L)
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
a.NaCl的浓度 b.海水的密度 c.盐类的溶解度 d.MgCl2的溶解度
(2)当海水密度达到1.13g/mL时,首先析出的盐是CaSO4,主要原因是a(选填编号).
a.CaSO4的溶解度最小 b.CaSO4的浓度最小 c.CaSO4的含量最高 d.CaSO4的溶解度最大
(3)为了使粗盐中除氯化钠外,含杂质较少,实际生产中卤水的密度控制的范围是1.21~1.26g/mL
(4)粗盐中所含的杂质离子有Mg2+、SO42-、Ca2+,现用BaCl2、NaOH、Na2CO3、HCl精制食盐水,其试剂的滴加顺序是BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl.
(5)食盐是重要的化工原料,写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑; 阳极的产物是Cl2,检验的方法是使湿润的碘化钾淀粉试纸变蓝.工业上将该产物与消石灰反应制得漂粉精,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.将电解产物氢气和氯气结合,生成氯化氢,溶于水即得盐酸,写出盐酸的电离方程式HCl=H++Cl-.
(6)在实验室用加热食盐浓硫酸的方法来制取氯化氢气体,写出在微热条件下反应的化学方程式NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.制得的氯化氢气体可做“喷泉”实验,利用同样的装置再举出一组可形成“喷泉”的气体与液体NH3和H2O.
20.已知有机物甲、乙、丙有如下信息:
据此推断:
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为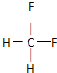 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.
A.其分子构型为正四面体形 B.它能使溴水褪色
C.1mol 乙最多能与1mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
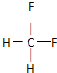 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.A.其分子构型为正四面体形 B.它能使溴水褪色
C.1mol 乙最多能与1mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
7.有短周期元素A、B、C,其中A、B同周期,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为 ( )
| A. | C、N、Si | B. | N、P、O | C. | N、O、S | D. | C、Si、S |
5.现有6种短周期元素的性质或原子结构如下表:
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是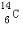 .
.
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的$\frac{1}{5}$ |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是
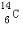 .
.(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.