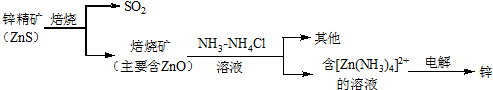
题目内容
10.如图是部分短周期元素原子半径与原子序数的关系图,则下列说法正确的是( )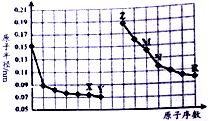
| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si,R为Cl元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si,R为Cl元素.
A.非金属性Y(F)>R(Cl),非金属性越强氢化物越稳定,故稳定性HF>HCl,故A错误;
B.
O2-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故B正确;
C.由X于N两种元素组成的化合物为二氧化硅,能与氢氟酸反应,故C错误;
D.Na单质与水反应生成氢氧化钠与氢气,不能从氯化铝溶液中置换出单质Al,故D错误,
故选:B.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
相关题目
20.已知有机物甲、乙、丙有如下信息:
据此推断:
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为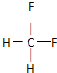 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.
A.其分子构型为正四面体形 B.它能使溴水褪色
C.1mol 乙最多能与1mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
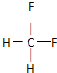 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.A.其分子构型为正四面体形 B.它能使溴水褪色
C.1mol 乙最多能与1mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
5.现有6种短周期元素的性质或原子结构如下表:
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是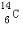 .
.
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的$\frac{1}{5}$ |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是
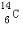 .
.(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
15.下列物质的使用不涉及化学变化的是( )
| A. | 制取粗硅 | B. | 用生石灰干燥氨气 | ||
| C. | 浓氨作制冷剂 | D. | 实验室中用棕色试剂瓶装浓HNO3 |
2.下表是大气固氮和工业固氮在不同温度下的K值,下列叙述吧正确的是的是( )
| 反应 | 大气固氮 | 工业固氮 | |||
| N2(g)+02(g)? 2NO(g) | N2(g)+3H2 (g)?2NH3(g) | ||||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84X10-31 | 0.1 | 5x103 | 0.507 | 0.152 |
| A. | 分析上表数据可知,大气固氮反应属于吸热反应 | |
| B. | 大气固氮正向反应K值太小,不适合大规模生产 | |
| C. | 从催化剂活性、反应速率等综合因索考虑,工业固氮应该选择适宜的温度 | |
| D. | 从平衡理论考虑,加压有利于氨的合成,所以在生产时压强越大越好 |
19.根据反应:2Ag++Cu═Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
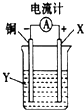

| A. | X可以是银或石墨 | B. | Y是硫酸铜溶液 | ||
| C. | 电子从铜电极经外电路流向X电极 | D. | X极发生还原反应 |