题目内容
14.元素钴的+3价配合物化学式为CoClm•nNH3,中心原子的配位数为6,NH3只做配体.若lmol该配合物的水溶液与足量AgN03反应,生成2mol AgCl,则m和n的值是( )| A. | m=5,n=l | B. | m=3,n=5 | C. | m=3,n=4 | D. | m=3,n=6 |
分析 元素钴的+3价配合物化学式为CoClm•nNH3,中心原子的配位数为6,NH3只做配体,配合物中配位离子Cl-不与Ag+反应,外界离子Cl-离子与Ag+反应,据此求出该配合物的化学式,进而确定m和n的值.
解答 解:元素钴的+3价配合物化学式为CoClm•nNH3,中心原子的配位数为6,NH3只做配体,配合物显电中性,即配合物中,含有3个Cl-,1mol该配合物生成2mol AgCl沉淀,则1mol该配合物中含2mol外界离子Cl-,即配离子中含有1个Cl-,又由于Co(+3价)的配位数为6,则NH3配位数为5,故该配合物的化学式可写为:[CoCl(NH3)5]Cl2,则m、n的值分别为:3、5,
故选B.
点评 本题考查配合物的结构,题目难度不大,注意配合物中配位离子Cl-不与Ag+反应,外界离子Cl-与Ag+反应.

练习册系列答案
相关题目
5.现有6种短周期元素的性质或原子结构如下表:
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是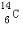 .
.
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的$\frac{1}{5}$ |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有16个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是
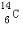 .
.(2)用离子方程式表示:
①元素Y与元素W形成的离子YW${\;}_{4}^{+}$与NaOH溶液共热NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
②元素U的单质与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素Z与元素T相比,非金属性较强的是Cl,下列表述中能证明这一事实的是b(填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是H2CO3(用分子式表示),理由是H2CO3是弱酸,其余均为强酸.
2.下表是大气固氮和工业固氮在不同温度下的K值,下列叙述吧正确的是的是( )
| 反应 | 大气固氮 | 工业固氮 | |||
| N2(g)+02(g)? 2NO(g) | N2(g)+3H2 (g)?2NH3(g) | ||||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84X10-31 | 0.1 | 5x103 | 0.507 | 0.152 |
| A. | 分析上表数据可知,大气固氮反应属于吸热反应 | |
| B. | 大气固氮正向反应K值太小,不适合大规模生产 | |
| C. | 从催化剂活性、反应速率等综合因索考虑,工业固氮应该选择适宜的温度 | |
| D. | 从平衡理论考虑,加压有利于氨的合成,所以在生产时压强越大越好 |
9.下列说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 纤维素属于高分子化合物,与淀粉互为同分异构体 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲酸分子中有醛基,因此无法区別甲醛溶液和甲酸溶液 |
19.根据反应:2Ag++Cu═Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
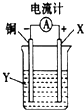

| A. | X可以是银或石墨 | B. | Y是硫酸铜溶液 | ||
| C. | 电子从铜电极经外电路流向X电极 | D. | X极发生还原反应 |
20.下列有关氟氯代烷的说法中,不正确的是( )
| A. | 氟氯代烷是一类含氟和含氯的卤代烃 | |
| B. | 氟氯代烷化学性质稳定,有毒 | |
| C. | 氟氯代烷大多无色、无臭、无毒 | |
| D. | 在平流层中,氟氯代烷在紫外线照射下,分解产生的氯原子可引发损耗臭氧层的循环反应 |
1.根据热化学方程式:S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |