题目内容
【题目】在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5Lmol-1)则:
(1)反应生成HCl气体的质量为__,转移电子的总数为___。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20gmL-1的盐酸,此盐酸的物质的量浓度为___。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需耍上述原料的质量是___t。(保留两位小数)
【答案】73g 4NA 12mol·L-1 SiO2+2C![]() Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
【解析】
(1)n=![]() =2mol,m=n×M=2mol×36.5g·mol-1=73g;
=2mol,m=n×M=2mol×36.5g·mol-1=73g;
根据方程式:
 可知,反应生成2mol氯化氢消耗1mol氯气和1mol氢气,共转移电子的物质的量为:1mol×2+1mol×2=4mol,故转移电子个数为4NA;
可知,反应生成2mol氯化氢消耗1mol氯气和1mol氢气,共转移电子的物质的量为:1mol×2+1mol×2=4mol,故转移电子个数为4NA;
故答案为:73g;4NA;
(2)V=![]() =
=![]() mL=
mL=![]() ×10-3L,C=
×10-3L,C=![]() =
=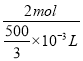 =12mol·L-1;故答案为:12mol·L-1;
=12mol·L-1;故答案为:12mol·L-1;
(3)焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C![]() Si+2CO↑;二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2═Na2SiO3+H2O,离子方程式为:2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2═Na2SiO3+H2O,离子方程式为:2OH-+SiO2═SiO32-+H2O;
故答案为:SiO2+2C![]() Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
(4)每天10t,其中含有Na2O质量10t×13%=1.3t,CaO质量10t×11.7%=1.17t,SiO2质量10t×75.3%=7.53t,而Na2O都是从Na2CO3中来,CaO都是从CaCO3中来,SiO2都是从石英中来,根据质量守恒可知设需要石灰石CaCO3质量x,纯碱Na2CO3质量y,石英SiO2质量z,则 80%x×=1.17t,即 80%x×![]() =1.17t,解得x≈2.61,95%y×
=1.17t,解得x≈2.61,95%y×![]() =1.3t,即95%y×
=1.3t,即95%y×![]() =1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
=1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
故答案为:12.88。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案

