题目内容
10. 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].Ⅰ.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图1所示装置,主要实验步骤如下:
步骤l:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中.
步骤2:从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管.
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶中铝过剩.
步骤4:加热烧瓶6,回流一定时间.
步骤5:将氮气的流动方向改为从导管口4到导管口l.将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2.
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处.
(1)步骤l中,铝箔用CCl4浸泡的目的是除去铝箔表面的油脂等有机物.
(2)步骤2操作中,通氮气的目的是排出装置中含有水蒸气的空气.
(3)步骤3中,该实验要保证烧瓶6中铝箔过剩,其目的是保证溴完全反应,防止溴过量混入溴化铝中.
(4)步骤4依据何种现象判断可以停止回流操作5的管中回流液呈无色(或烧瓶6中物质呈无色).
(5)步骤5需打开导管口l和4,并从4通入N2的目的是将AlBr3蒸气导入装置2中并冷凝.
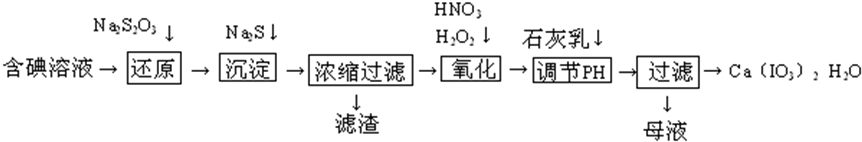
Ⅱ.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图2所示.实验中可选用的试剂:①处理过的铝箔;②2.0mol•L-1硫酸;③2.0mol•L-1NaOH溶液.
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0mol•L-1NaOH溶液,加热至不再产生气泡为止.
②过滤. ③滤液用2.0mol/L硫酸在不断搅拌下调到pH4-10左右.
④过滤、洗涤. ⑤沉淀中不断加入2.0mol/L硫酸,至恰好溶解.
⑥蒸发浓缩. ⑦冷却结晶. ⑧过滤、洗涤、干燥.
分析 I.(1)铝箔表面会有油污,根据相似相溶原理知,有机溶质易溶于有机溶剂;
(2)溴化铝易水解生成氢氧化铝和HBr;
(3)如果溴过量,溴易混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明可以停止回流;
(5)将溴化铝蒸汽导入装置2中并冷凝得到溴化铝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀;
⑥从溶液中获得晶体采用加热浓缩、冷却结晶的方法.
解答 解:I.(1)铝箔表面易沾有油脂,油脂属于有机物,根据相似相溶原理知,有机溶质易溶于有机溶剂,所以用四氯化碳除去铝箔表面的油脂,
故答案为:除去铝箔表面的油脂等有机物;
(2)溴化铝易水解生成氢氧化铝和HBr,为防止溴化物在空气中的水蒸气中水解,用氮气将装置中空气(含水蒸气)排出,
故答案为:排出装置中含有水蒸气的空气;
(3)如果溴过量,溴易混入溴化铝中,所以为保证液溴完全反应,该实验要保证烧瓶中铝箔过剩,
故答案为:保证溴完全反应,防止溴过量混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明溴恰好完全反应,则可以停止回流,
故答案为:5的管中回流液呈无色(或烧瓶6中物质呈无色);
(5)步骤5需打开导管口l和4,利用压强差将溴化铝蒸汽导入装置2并冷凝得到溴化铝,
故答案为:将AlBr3蒸气导入装置2中并冷凝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀,所以该步骤是向溶液中滴加稀硫酸并调节溶液pH为4-10,从而得到氢氧化铝沉淀,
故答案为:滤液用2.0mol/L硫酸在不断搅拌下调到pH4-10左右;
⑥沉淀中不断加入2.0mol/L硫酸,至恰好溶解,从溶液中获得晶体采用加热浓缩、冷却结晶的方法,所以该操作为蒸发浓缩,故答案为:沉淀中不断加入2.0mol/L硫酸,至恰好溶解.
点评 本题考查AlBr3、硫酸铝制备实验方案设计,侧重考查学生制备、操作等基本能力,明确实验原理是解本题关键,题目难度中等.

| 分类标准 | 能导电的物质 | 电解质 | 酸 |
| 属于该类的物质 |

| A. | 原子半径大小比较为A>B>C>D | B. | 生成的氢化物稳定性为A>B>C>D | ||
| C. | A与C形成的阴离子可能有AC${\;}_{3}^{2-}$ | D. | A、B、C、D的单质常温下均不导电 |
 Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
 ;
;

 对叔丁基苯酚(
对叔丁基苯酚(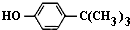 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.