题目内容
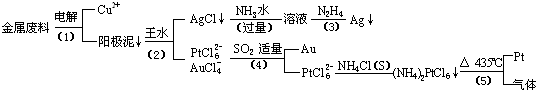
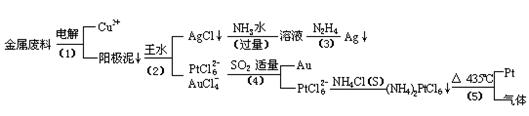
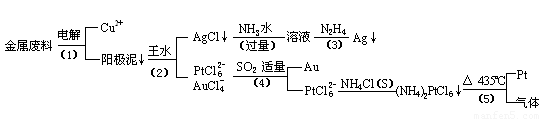
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:

根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解反应的阳极方程式:________
(2)写出步骤(4)的离子反应方程式:________;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:________.
(4)我们知道,稀盐酸与铜不反应.在稀盐酸中加入H2O2等氧化剂后,则可使铜顺利溶解.某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸.请在方格中画出该装置:
(5)分别将等质量的铜片与分别等体积、过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈兰色,甲同学提出可能是Cu2+浓度不同引起的,乙同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究甲乙两同学的说法谁更正确(简述实验方案和实验现象及由此得出的结论:________________
解析:
(1)Cu-2e-=Cu2+
(2)2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
(3)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水.
(4)电解装置,铜与电源的正极相连即可.若加硝酸钾或用铜与碳相连构成原电池可给1分.
(5)理论:等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得溶液中Cu2+的浓度基本相等;实验:将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则乙同学的结论正确,反之,不正确.若加水不给分.(其他合理答案也给分)

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案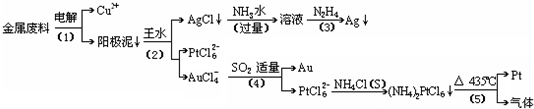
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O