题目内容
17.下列说法正确的是( )| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有1个电子的元素一定是第ⅠA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第2周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第3周期 |
分析 A、第ⅢA、第ⅣA族某些元素的最外层电子数等于或大于3,属于金属元素;
B、过渡元素29号的铜第四层也只有一个电子;
C、每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个;
D、如是阳离子,则位于第四周期,阴离子位于第三周期.
解答 解:A、第ⅢA的Al、Ga、In等最外层电子数为3,第ⅣA族的Ge、Sn等最外层电子数为4,属于金属元素,故A错误;
B、主族元素符合,但过渡元素29号的铜第四层也只有一个电子,故B错误;
C、每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个,显然外层电子数比次外层电子数多的元素一定位于第二周期,故C正确;
D、K+ ,最外层与次外层电子数相等,但K元素位于第四周期,故D错误.
,最外层与次外层电子数相等,但K元素位于第四周期,故D错误.
故选C.
点评 本题考查原子结构与元素在周期表中位置的关系,题目难度不大,本题注意把握元素周期表的结构以及原子核外电子排布特点.

练习册系列答案
相关题目
8.下列实验装置能够达到目的是( )
| A. | 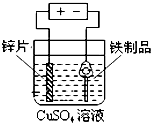 铁制品表面镀锌 | B. | 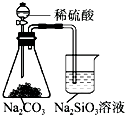 验证碳酸酸性强于硅酸 | ||
| C. | 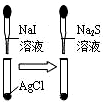 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
5.下列有机化合物分子中的所有碳原子不可能处于同一平面的是.
| A. | 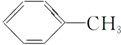 | B. | HC≡C-CH3 | ||
| C. | 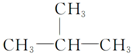 | D. |  |
2.X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是( )
| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成  分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
9.分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A. | 8种 | B. | 16种 | C. | 32种 | D. | 64种 |
6.已知钫(Fr) 和砹(At)分别是碱金属元素和卤族元素中原子序数最大的元素,关于两者性质的预测,不正确的是( )
| A. | 钫与水反应发生爆炸,生成的氢氧化物FrOH是一种极强的碱 | |
| B. | 钫极易在氧气中燃烧,燃烧生成复杂的氧化物 | |
| C. | 砹单质是有色气体,易溶于CCl4等有机溶剂 | |
| D. | 砹单质不容易与氢气化合 |
7.有8种物质:①乙烷;②乙烯;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应而使溴水褪色的是(( )
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
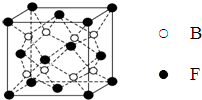 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)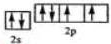 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族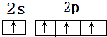 ,不符合能量最低原理原理.
,不符合能量最低原理原理.
 .
.