题目内容
7.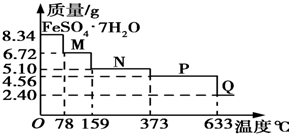 8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )
8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )| A. | 温度为78℃时固体物质M的化学式为FeSO4•5H2O | |
| B. | 温度为159℃时固体物质N的化学式为FeSO4•3H2O | |
| C. | 在隔绝空气条件下由N得到P的化学方程式为FeSO4═FeO+SO3↑ | |
| D. | 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
分析 8.34g FeSO4•7H2O样品物质的量=$\frac{8.34g}{278g/mol}$=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeSO4•7H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,铁的化合价升高,必有硫的化合价降低,即有二氧化硫生成,设SO2、SO3的物质的量分别为x、y,根据硫原子守恒及气体的质量列方程计算判断是否含有三氧化硫,以此解答该题.
解答 解:8.34g FeSO4•7H2O样品物质的量=$\frac{8.34g}{278g/mol}$=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeSO4•7H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3.
A.温度为78℃时,固体质量为6.72g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=6.72g-4.56g=2.16g,n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,则n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则化学式为FeSO4•4H2O,故100℃时,M的化学式为FeSO4•4H2O,故A错误;
B.温度为l59℃时,固体质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol,则n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则化学式为FeSO4•H2O,故B错误;
C.N的化学式为FeSO4•H2O,P化学式为FeSO4,在隔绝空气条件下由N得到P的化学方程式为:FeSO4•H2O$\frac{\underline{\;373℃\;}}{\;}$FeSO4+H2O,故C错误;
D.由上述分析可知,P化学式为FeSO4,Q的化学式为Fe2O3,铁的化合价升高,必有硫的化合价降低,即有二氧化硫生成,设SO2、SO3的物质的量分别为x、y,则$\left\{\begin{array}{l}{x+y=0.03}\\{64x+80y=4.56-2.4}\end{array}\right.$,解得x=y=0.015,所以方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,故D正确,
故选D.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意把握物质的质量的变化关系,能读懂图象,从质量守恒的角度解答该题,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 碳酸钠 | B. | 氢氧化钠 | C. | 碳酸氢钠 | D. | 氯化钠 |
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
| A. | 纤维素 | B. | 油脂 | C. | 葡萄糖 | D. | 酶 |
| A. | 塑料、纤维、橡胶是通常所说的三大合成材料 | |
| B. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| C. | 向蛋白质溶液中加入饱和硫酸铜溶液可产生盐析现象 | |
| D. | 可用灼烧的方法鉴别羊毛制品和纯棉织品 |
| A. | 煤的干馏、石油的分馏分别是化学变化、物理变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者不是同分异构体 | |
| C. | 可以用新制的氢氧化铜悬浊液检验患者尿液中的葡萄糖 | |
| D. | 饱和(NH4)2SO4溶液和饱和CuSO4溶液都能使蛋白质溶液产生沉淀,其作用原理相同 |
 如图所示.每个编号代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应,供填写的物质有:a.Na2CO3溶液 b MgSO4溶液 c BaCl2溶液 d稀硫酸 e 铁 f Cu(NO3)2溶液.
如图所示.每个编号代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应,供填写的物质有:a.Na2CO3溶液 b MgSO4溶液 c BaCl2溶液 d稀硫酸 e 铁 f Cu(NO3)2溶液.