题目内容
15.从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有HCl、CuCl2
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有H2SO4、Na2SO4、NaHSO4
(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有CuSO4NaCl.
分析 根据电解池的工作原理阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-;
(1)碳棒是惰性电极,惰性电极电解溶质本身时,电解质质量减小,水量不变;
(2)惰性电极电解水时,电解质质量不变,水量减少;
(3)石墨棒为电极,电解质与水都参与电解时,电解质和水量都减少.
解答 解:因阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-,则
(1)碳棒是惰性电极,惰性电极电解CuCl2溶液或者HCl溶液时,电解质质量减小,水量不变,故答案为:CuCl2、HCl;
(2)惰性电极电解H2SO4、Na2SO4、NaHSO4溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:H2SO4、Na2SO4、NaHSO4;
(3)石墨棒为电极,电解CuSO4、NaCl溶液时,则铜离子、氢氧根离子、氯离子、氢离子放电,所以电解质和水量都减少,故答案为:CuSO4、NaCl.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,知道各个电极上发生的反应,题目难度不大.

练习册系列答案
相关题目
9.具有相同价电子数和相同原子数的分子或离子间互称为等电子体,下列粒子不属等电子体的是( )
| A. | SO2和O3 | B. | H2O2和HCl | C. | NH2-和H2O | D. | CH4和NH4+ |
20.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温.实验测得相关数据如图1和图2.
下列有关说法正确的是( )
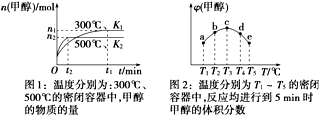
下列有关说法正确的是( )

| A. | 该反应的正反应是气体体积减小的吸热反应 | |
| B. | K1<K2(K为该条件下反应的平衡常数) | |
| C. | 反应进行到5 min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 | |
| D. | 将容器c中的平衡状态时的甲醇体积分数转变到容器d中的平衡状态的甲醇体积分数,可采取的措施有升温或减压 |
7.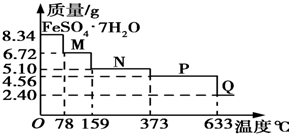 8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )
8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )
 8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )
8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )| A. | 温度为78℃时固体物质M的化学式为FeSO4•5H2O | |
| B. | 温度为159℃时固体物质N的化学式为FeSO4•3H2O | |
| C. | 在隔绝空气条件下由N得到P的化学方程式为FeSO4═FeO+SO3↑ | |
| D. | 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
4.下列实验能获得成功的是( )
| A. | 用纯碱溶液可鉴别出CCl4、C6H6、C2H5OH、CH3COOH | |
| B. | 用溴水、苯、铁屑制取溴苯 | |
| C. | 将无水乙醇加热到170℃制取乙烯 | |
| D. | 将冰醋酸、乙醇和2mol/L的硫酸加热制取乙酸乙酯 |
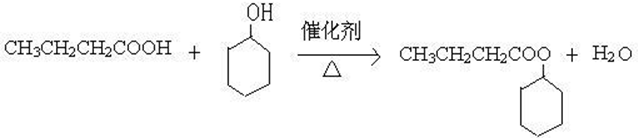 .
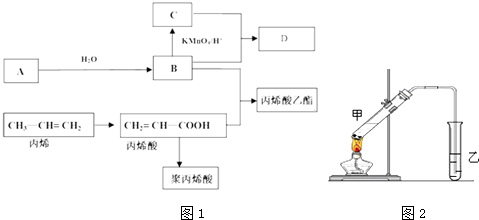
.
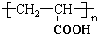 .
.