题目内容
19.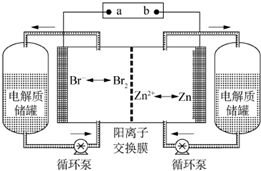 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 充电时,阳离子通过交换膜移向装置右侧 | |
| B. | 充电时,左侧与右侧的溴化锌溶液的浓度差将减小 | |
| C. | 放电时装置发生的总反应为:Zn+Br2═ZnBr2 | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
分析 根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极;
A、充电时,电池的正极和电源的正极相接,所以阳离子通过交换膜移向阴极;
B、根据电池的两极反应来确定浓度的变化;
C、放电时装置发生的总反应即为自发的氧化还原反应;
D、阳离子交换膜只允许阳离子通过,还起到隔膜的作用.
解答 解:根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极.
A、充电时,电池的正极和电源的正极相接,即电极b连接电源的负极即右侧为阴极,所以阳离子通过交换膜移向阴极装置右侧,故A正确;
B、充电时左侧溴离子转化为溴单质,则溴离子浓度减小,右侧为锌离子转化为锌单质,锌离子浓度减小,所以左侧的锌离子移向右侧,则左侧与右侧的溴化锌溶液的浓度差将增大,故B错误;
C、放电时装置发生的总反应即为自发的氧化还原反应:Zn+Br2═ZnBr2,故C正确;
D、阳离子交换膜只允许阳离子通过,还起到隔膜的作用,可阻止Br2与Zn直接发生反应,故D正确;
故选B.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列反应中,水既做氧化剂又做还原剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | SO2+H2O═H2SO3 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
10.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达平衡时,X的转化率为50% | |
| B. | 反应可表示为:X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 当混合气体的平均相对分子质量不变时,该反应达到了化学平衡状态 |
4.设NA为阿伏加德岁常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| C. | 50 mL18.4mol/L浓硫酸与足量铜微热反应,生成S02分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA |
11.为达到下列实验目的,所采用的方法合理的是( )
| A. | 溴水中提取溴:分液 | |
| B. | 分离水和汽油的混合物:蒸馏 | |
| C. | 分离饱和食盐水和沙子的混合物:过滤 | |
| D. | 从硝酸钾和氯化钠混合液中获取硝酸钾:萃取 |
8.下列离子方程式书写正确的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++C${O}_{3}^{2-}$═CaCO3↓ | |
| B. | NH4HSO3溶液与足量NaOH溶液混合加热: N${H}_{4}^{+}$+HS${O}_{3}^{-}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+S${O}_{3}^{2-}$+2H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++S${O}_{4}^{2-}$+H++OH-═BaSO4↓+H2O |
9.已知298K、101KPa条件下
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)是吸热反应 | |
| B. | 1 molH2O(g)转变成1 molH2O(l)放出44.0kJ热量 | |
| C. | 1 molH2O(l)转变成1 molH2O(g)放出44.0kJ热量 | |
| D. | 1 molH2O(g)转变成1 molH2O(l)放出88.0kJ热量 |