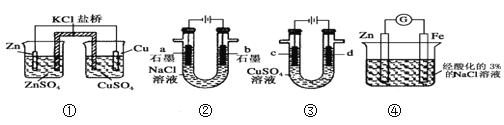
题目内容
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__。
(2)2min末时X的浓度为___。
(3)化学反应方程式中n=__。
(4)2min末,W的转化率__。
【答案】0.1mol·L-1·min-1 0.1mol·L-1 6 66.7%
【解析】
用不同物质表示的速率之比等于方程式的化学计量数之比确定用W表示的速率;根据方程式的计量数的关系求出2min末时X的浓度以及方程式中的n;W的转化率利用变化的物质的量处于起始的物质的量进行计算。
(1)以Z的浓度变化表示的反应速率为0.0025mol/(L·s)=0.15mol/(L·min),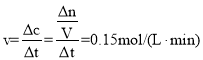 ,Δn=0.15mol/(L·min)×2min×2L=0.6mol,根据化学反应: 4W(g)+3X(g)2Y(g)+nZ(g),列出“三段式”,
,Δn=0.15mol/(L·min)×2min×2L=0.6mol,根据化学反应: 4W(g)+3X(g)2Y(g)+nZ(g),列出“三段式”,
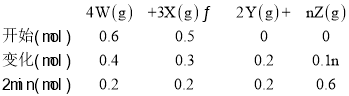
前2min内用W浓度变化表示的平均反应速率为v(W)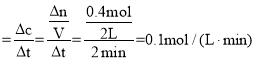 ;
;
(2)根据反应方程式,前2min内生成0.2molY消耗0.3molX,2min末X物质的量为0.5mol-0.3mol=0.2mol,2min末X的浓度为![]() ;
;
(3)由三段式可知,0.1n=0.6,解得n=6;
(4)2min末,W的转化率=![]() 66.7%。
66.7%。

练习册系列答案
相关题目