题目内容
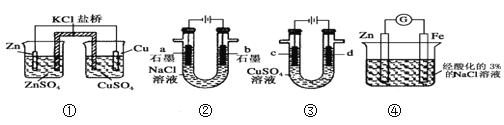
【题目】有关如图装置的说法正确的是( )

A. 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O
B. 若K与c连接,则溶液中的Na+向铁电极移动
C. 若K与d连接,铁电极的电极反应为:2H2O +2e-=H2↑+2OH-
D. 若K与d连接,短时间后,加适量稀盐酸可使电解质溶液复原
【答案】C
【解析】
A、若K与c连接,是原电池,石墨电极是正极,电极反应为:O2+4e-+2H2O=4OH-;
B、若K与c连接,是原电池,溶液中的Na+向正极移动;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H2O +2e-=H2↑+2OH-;
D、若K与d连接,短时间内是电解饱和食盐水,产生NaOH、氢气和氯气,短时间后通入氯化氢气体可使电解质溶液复原。
A、若K与c连接,是原电池,石墨电极是正极,是吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-,故A错误;
B、若K与c连接,是原电池,溶液中的Na+向正极移动,即钠离子向石墨极移动,故B错误;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H2O +2e-=H2↑+2OH-,故C正确;
D、若K与d连接,短时间内是电解饱和食盐水,产生NaOH、氢气和氯气,短时间后通入氯化氢气体可使电解质溶液复原,但深度电解后,要电解部分水,要加入稀盐酸,才可使电解质溶液复原,故D错误;
故选C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】一定温度下,20mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 | ||||
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈1.67×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<1.67×10-2mol/(Lmin)
C.反应至6min时,c(H2O2)=0.30mol/L
D.反应至6min时,H2O2分解了50%
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.

(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
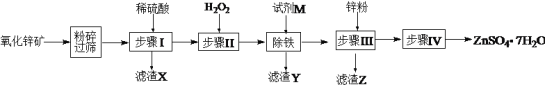
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
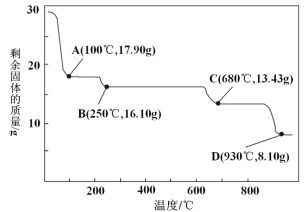
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O