题目内容
9.已知CO2+3H2?CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图1所示(单位为kJ•mol-1).①该反应的热化学方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-890 kJ•mol-1.
②该反应平衡常数K的表达式为$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$.
③在体积为1L的密闭容器中,充入1mol CO2和3mol H2反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到达到化学平衡,v(H2)=0.225mol/(L•min),下列措施中能使n(CH3OH)/n(CO2)增大的有CD(填字母).
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.再充入3mol H2 E.充入He(g),使体系总压强增大.
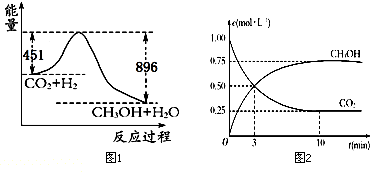
分析 ①由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,又22gCO2发生上述反应,放出热量为896-451=445KJ,据此书写热化学方程式;
②化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
③由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小.
解答 解:①由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,又22gCO2发生上述反应,放出热量为896-451=445KJ,所以1molCO2发生上述反应,放出热量为445KJ×2=890KJ,则反应的热化学方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-890 kJ•mol-1;
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-890 kJ•mol-1;
②可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的化学平衡常数k=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;
故答案为:$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;
③由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min);
使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小.
A.升高温度,平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.加入催化剂,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡正反应移动,平衡时n(CH3OH)/n(CO2)增大,故D正确;
E.充入He(g),反应混合物的浓度不变,变化不移动,n(CH3OH)/n(CO2)不变,故E错误;
故答案为:0.225;CD.
点评 考查平衡图象、化学平衡有关计算、反应速率、化学平衡的影响因素等,难度不大,注意基础知识的理解掌握,(5)中只增大二氧化碳的浓度会使该比值减小,可以借助平衡常数分析理解.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 明矾加入水中主要目的是悬浮杂质沉降 | |
| B. | 塑料、光导纤维、合成橡胶都属于有机高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可减少燃煤对大气的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于减少白色污染 |
| A. | pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 0.1 mol•L-1 NaHS溶液中:c(H+)+c(H2S)=c(S2-)+c(OH-) | |
| D. | 物质的量浓度相等的HF和NaF溶液等体积混合后:c(Na+)=c(HF)+c(F-) |
| A. | 回收其中的石墨电极 | |
| B. | 回收利用电池外壳的金属材料 | |
| C. | 不使电池中渗露的电解液腐蚀其他物品 | |
| D. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为2L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%;
(3)计算容器②中反应的平衡常数K=2;
(4)下列叙述正确的是ad(填字母序号);
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=$\frac{0.4}{{t}_{1}}$mol•L-1•min-1
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| D. | 1mol金刚石含4NAC-C键 |