题目内容
14.废电池进行集中处理的首要原因是( )| A. | 回收其中的石墨电极 | |
| B. | 回收利用电池外壳的金属材料 | |
| C. | 不使电池中渗露的电解液腐蚀其他物品 | |
| D. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
分析 电池中含有的汞、镉、铜等重金属对土壤和水源具有污染性,所以回收废电池的主要原因是防止电池中汞、镉和铅等重金属离子对土壤和水源的污染,据此进行判断.
解答 解:A.石墨资源丰富,回收电池仅是回收电池中的石墨电极意义不大,成本较高,故A错误;
B.回收电池目的是减少电池中汞、镉、铅等重金属离子污染土壤和水源,当然回收电池可充分利用电池外壳的金属,但不是首要目的,故B错误;
C.电池中渗出的电解质溶液不仅仅是腐蚀其他物品,更重要的是污染土壤和水源,故C错误;
D.电池中含有重金属离子,若不回收容易对土壤、水资源造成污染,所以回收废电池的主要原因是防止废电池中渗漏出的重金属离子如汞、镉对土壤和水源的污染,故D正确;
故选D.
点评 本题考查了三废处理及环境保护的知识,题目难度不大,侧重考查废旧电池的回收利用知识,注意明确废旧电池含有大量汞、镉、铅等重金属离子,会导致土壤、水源的污染.

练习册系列答案
相关题目
4.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00mL密度为ρ g/mL的过氧化氢溶液稀释至250mL.量取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样.此过程中需要用到的定量仪器250ml容量瓶,滴定管或移液管.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程
2MnO4-+5H2O2+6H+→2Mn2++8H2O+502
(3)滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为0.085cVρ.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高(填“偏高”“偏低”“不变”).
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、淀粉碘化钾溶液、二氧化锰,实验仪器及用品可自选.)
请将他们所选的实验试剂和实验现象填入下表:
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00mL密度为ρ g/mL的过氧化氢溶液稀释至250mL.量取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样.此过程中需要用到的定量仪器250ml容量瓶,滴定管或移液管.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程
2MnO4-+5H2O2+6H+→2Mn2++8H2O+502
(3)滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为0.085cVρ.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高(填“偏高”“偏低”“不变”).
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、淀粉碘化钾溶液、二氧化锰,实验仪器及用品可自选.)
请将他们所选的实验试剂和实验现象填入下表:
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
5.NM-3是处于临床试验阶段的小分子抗癌药物,分子结构如图所示,下列说法正确的是( )

| A. | 该有机物的分子式为C12H12O6 | |
| B. | 该有机物的分子中只含有1个手性碳原子 | |
| C. | 可用FeCl3溶液检验该有机物质中是否含有苯酚 | |
| D. | 1mol该有机物最多可以和4molNaOH反应 |
2.2,3,4-三甲基戊烷的一氯代物可能有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
19.下述实验方案能达到实验目的是( )
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 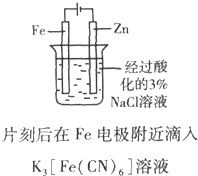 证明Fe电极被保护 | |
| C. | 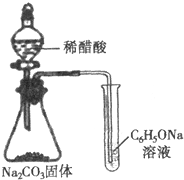 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 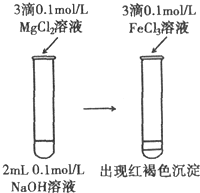 溶解度:Mg(OH)2>Fe(OH)3 |
6.某烷烃的结构简式是CH3CH2CH2CH(CH2CH3)CH3,它的正确命名是( )
| A. | 3-甲基己烷 | B. | 4-乙基戊烷 | C. | 2-乙基戊烷 | D. | 2,2-二甲基戊烷 |
4.高温下,反应2HBr(g)?H2(g)+Br(g)(正反应吸热反应),要使混合气体颜色变深,可采用的方法是( )
| A. | 减小压强 | B. | 缩小体积 | C. | 降低温度 | D. | 增大氢气的浓度 |
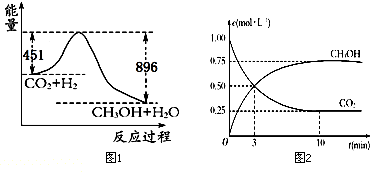
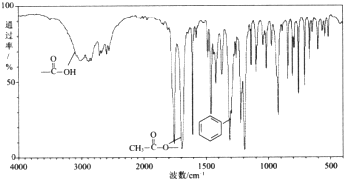
 ,X在一定条件下能发生的反应是acd(选填字母);
,X在一定条件下能发生的反应是acd(选填字母); )能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是
)能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是 ;
; ②苯环上的一溴代物只有两种
②苯环上的一溴代物只有两种 :
:
 .
.