题目内容
17.某溶液中含有K+、NH4+、Al3+、OH-、AlO2-、SO42-、CO32-、SiO32-、Cl-等离子中的某几种.现进行如下实验:①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉淀不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;②取①所得溶液,加入Ba(OH)2溶液,无明显现象.(1)原溶液中肯定存在的离子是AlO2-、CO32-、OH-、K+;肯定不存在的离子是Al3+、SiO32-、SO42-、NH4+.
(2)已知用一定体积的原溶液进行实验①时,需消耗0.2mol/L的盐酸5mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中有(填“有”“没有”或“不确定”)Cl-.
分析 取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,说明此溶液中含有氢氧根,强碱性溶液中一定不存在Al3+和NH4+,在沉淀不再增加后又产生一种无色气体,该气体为二氧化碳气体,一定存在CO32-,在气体不再产生后沉淀开始溶解,直至最后完全消失,一定不存在SiO32-,一定存在AlO2-;②取①所得溶液,加入Ba(OH)2溶液,无明显现象,说明一定不存在SO42-,据此解答即可.
解答 解:取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,说明此溶液中含有氢氧根,强碱性溶液中一定不存在Al3+和NH4+,在沉淀不再增加后又产生一种无色气体,该气体为二氧化碳气体,一定存在CO32-,在气体不再产生后沉淀开始溶解,直至最后完全消失,一定不存在SiO32-,一定存在AlO2-;②取①所得溶液,加入Ba(OH)2溶液,无明显现象,说明一定不存在SO42-,由电中性原则可知,溶液中一定存在钾离子,
(1)原溶液中肯定存在的离子是:AlO2-、CO32-、OH-、K+;肯定不存在的离子是:Al3+、SiO32-、SO42-、NH4+.故答案为:AlO2-、CO32-、OH-、K+;Al3+、SiO32-、SO42-、NH4+;
(2)0.2mol/L的盐酸5mL,氯离子的物质的量=0.2mol×0.005L=0.001mol,此时生成氯化银沉淀为:0.001mol×143.5g/mol=0.1435g<0.187g,故溶液中存在氯离子,故答案为:有.
点评 本题是一道离子检验和离子反应知识的综合题目,考查学生分析和解决问题的能力,难度大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列说法正确的是( )
| A. | 萘(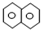 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,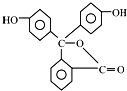 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 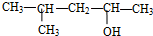 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
8.下列物质发生变化时,所克服的粒子间的相互作用属同种类型的是( )
| A. | 液态HF与液态HBr分别受热变为气体 | |
| B. | 氯化铵与苯分别受热变为气体 | |
| C. | 氯化钠与氯化氢分别溶解在水中 | |
| D. | 碘与干冰分别受热变为气体 |
5.NM-3是处于临床试验阶段的小分子抗癌药物,分子结构如图所示,下列说法正确的是( )

| A. | 该有机物的分子式为C12H12O6 | |
| B. | 该有机物的分子中只含有1个手性碳原子 | |
| C. | 可用FeCl3溶液检验该有机物质中是否含有苯酚 | |
| D. | 1mol该有机物最多可以和4molNaOH反应 |
2.2,3,4-三甲基戊烷的一氯代物可能有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.某烷烃的结构简式是CH3CH2CH2CH(CH2CH3)CH3,它的正确命名是( )
| A. | 3-甲基己烷 | B. | 4-乙基戊烷 | C. | 2-乙基戊烷 | D. | 2,2-二甲基戊烷 |
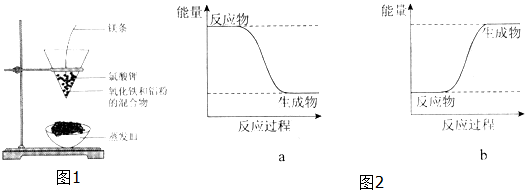
 Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.