题目内容
9.已知:C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
分析 A、所有的燃烧反应属于放热反应;
B、以碳作为还原剂的反应通常为吸热反应,铜的氧化属于放热反应;
C、根据盖斯定律利用加合法进行分析;
D、根据盖斯定律利用加合法进行分析.
解答 解:A、所有的燃烧反应属于放热反应,因此△H1<0,△H3<0,故A错误;
B、碳还原二氧化碳的反应属于吸热反应,△H2>0,铜与氧气的反应属于放热反应,△H4<0,故B错误;
C、已知:①C(s)+O2(g)═CO2(g)△H1②CO2(g)+C(s)═2CO(g)△H2③2CO(g)+O2(g)═2CO2(g)△H3,由盖斯定律可知①=②+③,因此△H1=△H2+△H3,则△H2=△H1-△H3,故C正确;
D、已知③2CO(g)+O2(g)═2CO2(g)△H3④4Fe(s)+3O2(g)═2Fe2O3(s)△H4⑤3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5,由盖斯定律可知③=$\frac{2}{3}$×($\frac{1}{2}$④+⑤),因此△H3=$\frac{1}{3}$△H4+$\frac{2}{3}$△H5,故D错误;
故选C.
点评 本题考查了常见的吸热反应和放热反应类型、盖斯定律的计算,题目难度中等,熟悉常见的吸热反应和放热反应类型、根据盖斯定律利用加合法进行有关计算的步骤是解题的关键.

练习册系列答案
相关题目
16.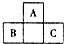 如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )
如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )
 如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )
如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )| A. | A、B、C三者均为非金属元素 | B. | B与C只能形成一种共价化合物 | ||
| C. | A与B、A与C均可形成离子化合物 | D. | A、B、C三者最外层电子数之和为40 |
17.下列说法正确的是( )
| A. | NH4Cl固体为离子化合物 | |
| B. | CO2分子中含有离子健 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | X2+的核外有18个电子,则X在第四周期第ⅡA族 |
14.下列物质不是以石油、煤、天然气为原料生产的是( )
| A. | 食醋 | B. | 塑料 | C. | 合成橡胶 | D. | 合成纤维 |
1.X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4.则下列说法正确的是( )
| A. | 元素的非金属性:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:Z>Y>X |
19.1919年,Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征.下列各对粒子中,空间结构相似的是( )
| A. | CS2与NO2 | B. | CO2与N2O | C. | SO2与O2 | D. | PCl3与BF3 |
 氧元素与多种元素具有亲和力,所形成化合物的种类很多.
氧元素与多种元素具有亲和力,所形成化合物的种类很多.