题目内容
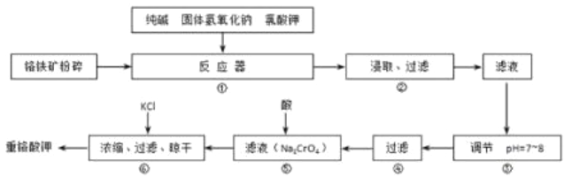
【题目】重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
【答案】(1)Al2O3+Na2CO3=2NaAlO2+CO2↑;(2)2CrO42-+2H+=Cr2O72-+H2O;
(3)取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较。
(4)
(5)①250 mL容量瓶 胶头滴管②94. 08%
【解析】
试题分析:(1)Al2O3与Na2CO3生成可溶性盐,则应为NaAlO2,根据原子守恒另一种产物为CO2,反应的方程式为Al2O3+Na2CO3=2NaAlO2+CO2↑。
(2)酸化即加酸,CrO42-和H+反应生成Cr2O72-和H2O,方程式为2CrO42-+2H+=Cr2O72-+H2O;
NaFeO2水解产生沉淀,则沉淀只能是Fe(OH)3,另一种产物为NaOH。
(3)测定pH值的实验操作为:取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较。
(4)滤液中加入足量盐酸后产生沉淀,则该沉淀一定是硅酸;要得到氢氧化铁沉淀,则需要加入强碱,例如氢氧化钠等;偏铝酸钠与CO2反应生成白色胶状沉淀氢氧化铝。
(5)①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需250 mL容量瓶和胶头滴管。
②根据发生的反应:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-
可得出关系式:Cr2O72-~3I2~ 6S2O32-
因此样品中所含重铬酸钾的物质的量为
![]()
所以重铬酸钾的纯度为![]() 。
。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6