题目内容
【题目】I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
【答案】(1)-23.5(2分)
(2)K=c(CO2)/c(CO)(1分)60%(2分)(3)d(1分)
(4)CH4-8e-+4O2-=CO2+2H2O(2分)(5)5.6(2分)
【解析】
试题分析:I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+3/2O2(g)=Fe2O3(s)△H=-825.5kJ/mol
由盖斯定律①×3/2-②得到Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的反应热△H=-23.5kJ/mol;
2Fe(s)+3CO2(g)的反应热△H=-23.5kJ/mol;
II (1)根据方程式可知该反应的平衡常数表达式为K= c(CO2)/c(CO);令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
起始量(mol) 1 1
转化量(mol) n n
平衡量(mol) 1-n n+1
所以(n+1)/(1n)=4,解得n=0.6,则CO的平衡转化率为0.6mol/1mol×100%=60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,a错误;b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,b错误;c.加入合适的催化剂,平衡不移动,c错误;d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,d正确;答案选d;
III、(4)B极上通入甲烷,是负极,甲烷失去电子转化为二氧化碳,电极反应式为CH4-8e-+4O2-=CO2+2H2O。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,阳极是氢氧根放电产生氧气,即氧气是11.2L÷22.4L/mol=0.5mol,转移0.5mol×4=2mol电子,根据电子转移守恒可知消耗甲烷的物质的量是2mol÷8=0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。

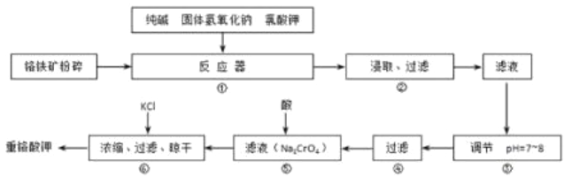
【题目】重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)