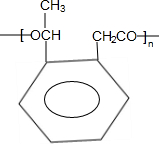
题目内容
15.在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解肯定不可能是( )| A. | $\frac{100b}{a}$g | B. | $\frac{200b}{a}$g | C. | $\frac{100b}{a+b}$g | D. | $\frac{100(a+b)}{a}$g |
分析 溶解度是指在某温度下,在100g水中当达到饱和时所能溶剂的溶质的质量;
由于在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液,由于溶质的质量为bg,则溶剂水的质量为ag,即bg溶质能完全溶剂于ag水中,此时形成的为未饱和溶液或饱和溶液.
若形成的为饱和溶液,设固体A的溶解度为xg,根据 ag~bg
100g~xg
此时计算出的x为溶解度的最小值,据此分析.
解答 解:溶解度是指在某温度下,在100g水中当达到饱和时所能溶剂的溶质的质量;
由于在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液,由于溶质的质量为bg,则溶剂水的质量为ag,即bg溶质能完全溶剂于ag水中,此时形成的顶多是饱和溶液.
①若bg溶质能完全溶剂于ag水中形成的为饱和溶液,设固体A的溶解度为xg,根据 ag~bg
100g~xg
则有:$\frac{a}{100}=\frac{b}{x}$
解得x=$\frac{100b}{a}$g.
②若bg溶质能完全溶剂于ag水中形成的为不饱和溶液,则溶解度x>$\frac{100b}{a}$g.
故固体A的溶解度要≥$\frac{100b}{a}$g.故不可能为$\frac{100b}{a+b}$g,
故选C.
点评 本题考查了物质溶解度的计算,应注意的是根据当bg溶质能完全溶剂于ag水中形成的可能是饱和溶液,还可能为不饱和溶液来分析计算,难度适中.

练习册系列答案
相关题目
5.科学家在对原子核进行显微解剖时,发现了一种氟的同位素299F,该同位素原子核内的中子数 是( )
| A. | 9 | B. | 20 | C. | 29 | D. | 38 |
6.常温下,一定体积pH=3的二元弱酸H2R溶液与一定体积pH=11的NaOH溶液混合后,溶液呈中性.下列判断正确的是( )
| A. | 溶液中c(Na+)═10-3mol/L | B. | 溶液中 c(R2-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 溶液中 c(R2-)+c(OH-)+c(HR-)═c(Na+)+c(H+) | D. | 溶液中 2c(R2-)+c(HR-)═c(Na+) |
10.用NA表示阿伏加德罗常数,下列的叙述正确的是( )
| A. | 在2L0.15 mol/L K2SO4溶液中,含有K+和SO42-的总数为0.9NA | |
| B. | 在标准状况下46 g NO2含有NA个分子 | |
| C. | ag某气体含有分子数为b,则c g该气体在标准状况下的体积是$\frac{22.4bc}{a{N}_{A}}$L | |
| D. | 当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA |
7.室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
4. 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
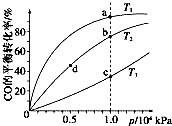
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
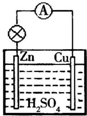 原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.
原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.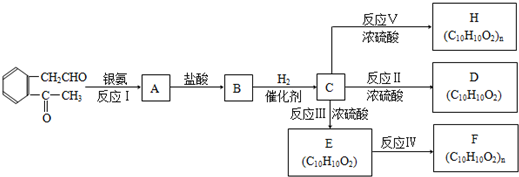
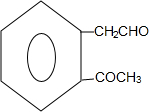 +2Ag(NH3)2OH→
+2Ag(NH3)2OH→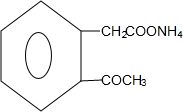 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;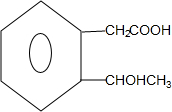 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$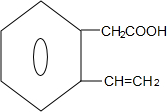 +H2O
+H2O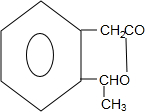 F
F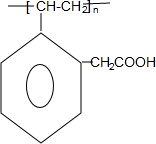 H
H