题目内容
3.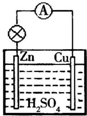 原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.
原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.
分析 原电池是直接把化学能转化为电能的装置,活泼金属做负极;负极上活泼金属失电子发生氧化反应;正极上溶液中的阳离子得电子发生还原反应.
解答 解:原电池是直接把化学能转化为电能的装置,在Cu-Zn原电池中,活泼金属Zn做负极;负极上Zn失电子发生氧化反应生成锌离子,其电极反应为:Zn-2e-=Zn2+;正极上溶液中的氢离子得电子发生还原反应生成氢气,其电极反应式为:2H++2e-=2H2↑;
故答案为:化学;电;氧化;负;Zn-2e-=Zn2+;还原;正; 2H++2e-=2H2↑.
点评 本题考查了原电池原理,负极发生氧化反应,正极发生还原反应,题目难度中等.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 硫酸溶液与氧氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 向水中通入氯气:Cl2+H2O?2H++Cl-+ClO- | |
| C. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2Na2O2═4OH-+4Na++18O2↑ |
18.下列各冶炼方法中,不能制得相应金属的是( )
| A. | 把铁放入硫酸铜溶液中 | B. | 加热氧化铝 | ||
| C. | 铝粉与氧化铁高温共热 | D. | 电解熔融氯化钠 |
8.对于反应:K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,若有0.1molK2Cr2O7参加反应,下列说法正确的是( )
| A. | 被氧化的HCl为1.4mol | B. | 转移电子数1.806×1023 | ||
| C. | 氧化产物为0.4mol | D. | 还原剂占参加反应HCl的$\frac{3}{7}$ |
15.在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解肯定不可能是( )
| A. | $\frac{100b}{a}$g | B. | $\frac{200b}{a}$g | C. | $\frac{100b}{a+b}$g | D. | $\frac{100(a+b)}{a}$g |
12.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 碱石灰 | 氧化铝 | 二氧化硫 |
| C | 水银 | 水玻璃 | 铁 | 碳酸钙 |
| D | 食醋 | 水煤气 | 氯化铜 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
13.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的成分是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
 ;
; .
.