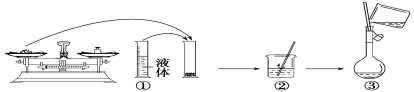
题目内容
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
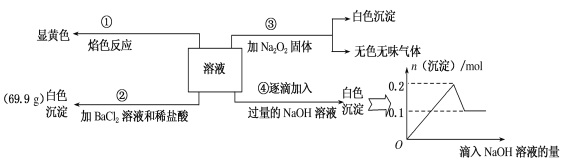
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___,一定不存在的离子有____。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
(4)将一定量Fe2O3和Al2O3混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
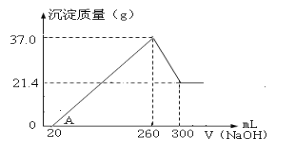
①混合物中含Fe2O3的质量为___g;
②所用硫酸溶液物质的量浓度为___mol/L。
【答案】物理 O2 Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+ 0.6mol/L 16g 6.5mol/L
【解析】
溶液呈无色,则一定不含有色离子:Fe3+、Cu2+;
①溶液焰色反应呈黄色,说明溶液中含有Na+离子;
②加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子;
③加入Na2O2.与水反应生成NaOH,生成白色沉淀,说明有Mg2+,判断一定无CO32-,生成无色无味气体,为O2,说明没有NH4+;
④逐滴加入过量NaOH溶液有白色沉淀,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子;
综上所述可知:溶液中一定含有Na+、Mg2+、Al3+、SO42-,一定没有Fe3+、Cu2+、CO32-、NH4+,不能判断溶液中是否含有K+。
(1)焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,没有生成新物质,是物理变化;
实验③中Na2O2与溶液中的水发生反应:2Na2O2+2H2O=4NaOH+O2↑,产生的无色无味的气体是O2;
(2)根据上述分析,原溶液中一定含有Na+、Mg2+、Al3+、SO42-,一定没有Fe3+、Cu2+、CO32-、NH4+,不能判断溶液中是否含有K+;
(3)实验②中产生的BaSO4白色沉淀的物质的量为n(BaSO4)=69.9g÷233g·mol-1=0.3mol,依据图形变化可知,剩余的固体为Mg(OH)2,其物质的量为0.1mol,则Mg2+物质的量为0.1mol;溶解的固体为Al(OH)3,其物质的量为0.1mol,则Al3+物质的量为0.1mol,由于溶液体积为100ml,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol·L-1-0.4mol·L-1-3×1mol·L-1-2×1mol·L-1=0.6mol·L-1;
(4)Fe2O3和Al2O3,与稀硫酸反应生成Fe3+、Al3+,加入NaOH溶液,刚开始没有沉淀生成,说明溶液中还有H+,随后Fe3+和Al3+,与碱生成Fe(OH)3、Al(OH)3,260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,再滴加NaOH,Al(OH)3溶解。
①260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,根据图示剩余的Fe(OH)3的质量为21.4g。Fe2O3+6H+=2Fe3++3H2O,Fe3++3OH-=Fe(OH)3↓,可得关系式Fe2O3~2Fe(OH)3,Fe(OH)3的质量为21.4g,其物质的量![]() ,则Fe2O3的物质的量为0.1mol,其质量为m=nM=0.1mol×160g·mol-1=16g;
,则Fe2O3的物质的量为0.1mol,其质量为m=nM=0.1mol×160g·mol-1=16g;
②溶解的Al(OH)3的质量为37g-21.4g=15.6g,其物质的量![]() 溶解Al(OH)3消耗了40mLNaOH,离子方程式为Al(OH)3+OH-=AlO2-
溶解Al(OH)3消耗了40mLNaOH,离子方程式为Al(OH)3+OH-=AlO2-![]() 。260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,可以根据原子守恒,求出H2SO4的物质的量浓度,有H2SO4~SO42-~2Na+,则c(NaOH)V(NaOH)=2c(H2SO4)V(H2SO4),5mol/L×0.26L=2×c(H2SO4)×0.1L,得c(H2SO4)=6.5mol/L。
。260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,可以根据原子守恒,求出H2SO4的物质的量浓度,有H2SO4~SO42-~2Na+,则c(NaOH)V(NaOH)=2c(H2SO4)V(H2SO4),5mol/L×0.26L=2×c(H2SO4)×0.1L,得c(H2SO4)=6.5mol/L。

【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。