题目内容
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
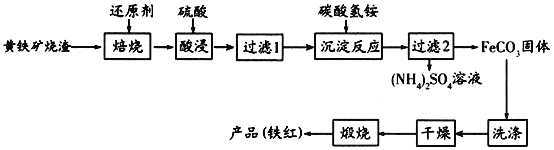
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
【答案】a ![]()
![]() 稀盐酸和
稀盐酸和![]()
![]() 37.5%
37.5%
【解析】
本题要从含有杂质的黄铁矿烧渣中得到铁红(Fe2O3),第一步焙烧将所有氧化物还原为单质铁和单质硅,接下来用硫酸酸浸将铁转变为Fe2+,硅不与硫酸反应,可以过滤除去;接下来加入碳酸氢铵,得到FeCO3沉淀,过滤、洗涤、干燥后再煅烧,煅烧时+2价的Fe被空气中的氧气氧化,最终得到Fe2O3,据此来分析即可。
(1)焙烧时加入焦炭是最好的选择,焦炭可以还原铁的氧化物和硅的氧化物,过量的焦炭在酸浸时不溶于硫酸,过滤即可除去,答案选a;
(2)根据分析,过滤1后的滤液中溶质的主要成分是![]() 溶液;
溶液;
(3)![]() 极易被空气中的氧气氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
极易被空气中的氧气氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(4)检验FeCO3是否洗涤干净,只要检验最后的洗涤液中是否含有![]() 即可,因此我们可以取最后一次洗涤液,加入稀盐酸和
即可,因此我们可以取最后一次洗涤液,加入稀盐酸和![]() 溶液,若无白色沉淀产生则证明已经洗涤干净;
溶液,若无白色沉淀产生则证明已经洗涤干净;
(5)空气中有氧气,根据原子守恒,在空气中煅烧FeCO3生成Fe2O3和CO2,反应的化学方程式为4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(6)黄铁矿烧渣中铁元素的质量为![]() ,根据Fe守恒,理论上能产生铁红的质量为
,根据Fe守恒,理论上能产生铁红的质量为![]() ×160g/mol=240t的铁红,产品的产率为
×160g/mol=240t的铁红,产品的产率为![]() 。
。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
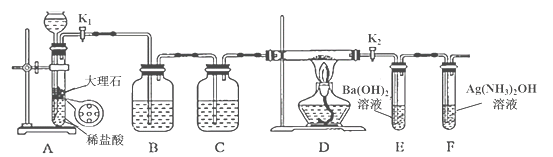
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |