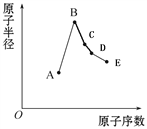
题目内容
【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。
【答案】20 3d 5 sp3 < MgH2 氨气分子之间可以形成氢键 ![]() 非极性 90NA H2R
非极性 90NA H2R ![]()
【解析】
(1)①Ti是22号元素,原子核外有22个电子,Ti原子失去两个电子生成Ti2+,该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论判断B原子的杂化方式;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,H为-1价,根据化合价判断化学键;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂;
②根据图知,每个C原子含有σ 键个数=![]() ×3=1.5;
×3=1.5;
(5)该晶胞中H原子个数=2+4×![]() =4,R原子个数=1+8×
=4,R原子个数=1+8×![]() =2,H、R原子个数之比=4:2=2:1;根据密度和摩尔质量计算V=
=2,H、R原子个数之比=4:2=2:1;根据密度和摩尔质量计算V=![]() 。
。
(1)①Ti是22号元素,Ti原子核外有22个电子,Ti原子失去两个电子生成Ti2+,基态Ti2+中含有的电子数为20;该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论知B原子的杂化方式为sp3;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Li+<H-;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,为Mg元素,H为-1价,该化合物化学键为MgH2;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高,氨气分子和磷化氢结构相似,但氨气中含有氢键,导致熔沸点升高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键,其结构式为![]() ;
;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂,C60晶体易溶于苯、CS2,C60是非极性分子;
②根据图知,每个C原子含有σ键个数=![]() ×3=1.5,1mol该物质中σ键个数=1.5×60×1mol×NA/mol=90NA;
×3=1.5,1mol该物质中σ键个数=1.5×60×1mol×NA/mol=90NA;
(5)该晶胞中H原子个数=2+4×![]() =4,R原子个数=1+8×
=4,R原子个数=1+8×![]() =2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积=
=2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积= cm3=
cm3=![]() cm3。
cm3。

 暑假接力赛新疆青少年出版社系列答案
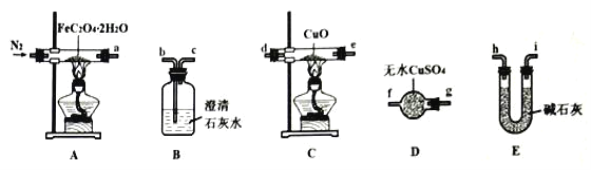
暑假接力赛新疆青少年出版社系列答案【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
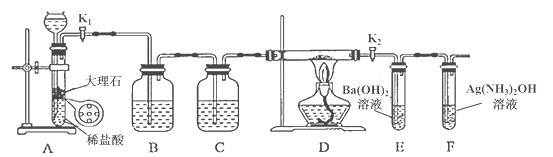
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |