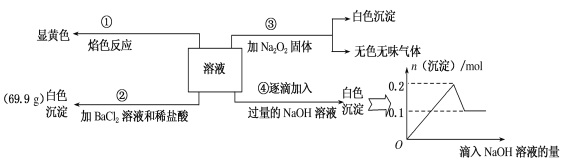
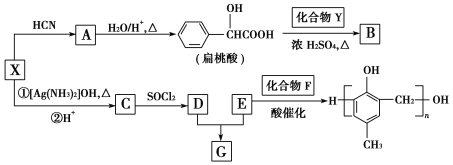
题目内容
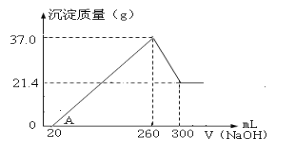
【题目】把7.5 g镁铝合金的粉末放入200ml 4mol/L的盐酸中,往充分反应后的混合溶液中逐渐滴入一定物质的量浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如图所示。

(1)合金中镁的物质的量为_______。
(2)氢氧化钠的物质的量浓度为_______mol/L。
(3)V1=_______mL。
(4)写出该合金溶于足量NaOH溶液的化学方程式为_________。
【答案】0.2mol 2 450 ![]()
【解析】
镁铝合金与盐酸反应后溶液有铝离子、镁离子、以及剩余的氢离子;加入氢氧化钠后氢氧化钠先于氢离子反应,此时无沉淀产生,之后镁、铝离子开始沉淀,发生反应 Al3++3OH-═Al(OH)3↓、 Mg2++2OH-═Mg(OH)2↓,当沉淀达到最大值时溶液中的溶质只有NaCl,再继续滴加氢氧化钠,氢氧化铝沉淀开始溶解,发生反应Al(OH)3+OH-═AlO2-+2H2O,据此进行解答。
(1)当滴加400mL氢氧化钠溶液时,沉淀达到最大值,此时溶液中的溶质为NaCl,根据元素守恒可知此时溶液中n(Cl-)=0.2L×4mol/L=0.8mol,由电荷守恒可知n(Na+)= n(Cl-)=0.8mol,即400mL氢氧化钠溶液中n(Na+)=0.8mol,则其浓度c(NaOH)=![]() ;此时溶液中据图可知前50mL氢氧化钠溶液没有沉淀产生,即此时发生反应H++OH-=H2O,所以与镁铝合金反应后剩余的n(H+)=0.05L×2mol/L=0.1mol,则与镁铝合金反应的n(H+)=0.8mol-0.1mol=0.7mol,设镁铝合金中镁的物质的量为xmol,铝的物质的量为ymol,则有24x+27y=7.5g,根据电子守恒(镁铝失去的电子都转移给氢离子)可得2x+3y=0.7,联立解得x=0.2mol,y=0.1mol,故答案为:0.2mol;
;此时溶液中据图可知前50mL氢氧化钠溶液没有沉淀产生,即此时发生反应H++OH-=H2O,所以与镁铝合金反应后剩余的n(H+)=0.05L×2mol/L=0.1mol,则与镁铝合金反应的n(H+)=0.8mol-0.1mol=0.7mol,设镁铝合金中镁的物质的量为xmol,铝的物质的量为ymol,则有24x+27y=7.5g,根据电子守恒(镁铝失去的电子都转移给氢离子)可得2x+3y=0.7,联立解得x=0.2mol,y=0.1mol,故答案为:0.2mol;
(2)根据(1)可知答案为:2;
(3)400mL至V1mL发生反应Al(OH)3+OH-═AlO2-+2H2O,根据(1)可知镁铝合金中铝的物质的量为0.1mol,则生成氢氧化铝0.1mol,此段消耗n(OH-)=0.1mol,所以消耗的氢氧化钠体积V=![]() ,即50mL,所以V1=400+50=450,故答案为:450;
,即50mL,所以V1=400+50=450,故答案为:450;
(4)该合金中铝单质可以与氢氧化钠溶液反应生成偏铝酸钠和氢气,故答案为:![]() 。
。